
����Ŀ������������![]() ��Ҫ�����մɡ������ȵ���ɫ���ϣ�Ҳ����������������ء���������֪��
��Ҫ�����մɡ������ȵ���ɫ���ϣ�Ҳ����������������ء���������֪��
��![]() ��ҵ�����ú�������
��ҵ�����ú�������![]() ���������ơ�þ�Ͻ�Ϊ��
���������ơ�þ�Ͻ�Ϊ��![]() ��ȡ������
��ȡ������![]() ���ٸ������ղ�������ȡ������������
���ٸ������ղ�������ȡ������������
��![]() ����ĸơ�þ�����ξ�������ˮ��
����ĸơ�þ�����ξ�������ˮ��
��![]() ��
��![]() ��
��
�������й�������ʾ��ͼ�ش����⡣
![]() ����
����![]() ��������Ҫ��Ӧ�����ӷ���ʽΪ______������
��������Ҫ��Ӧ�����ӷ���ʽΪ______������![]() ��Һ��pH��
��Һ��pH��![]() ����Ŀ��Ϊ______�����������
����Ŀ��Ϊ______�����������![]() ��������Һ��
��������Һ��![]() ______��
______��
![]() ������
������![]() ���ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�
���ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�![]() ��ͬʱ��û�����塣���������ȷֽ�Ļ�ѧ����ʽΪ______��
��ͬʱ��û�����塣���������ȷֽ�Ļ�ѧ����ʽΪ______��
![]() ��ҵ�ϻ����õ�ⷨ��ȡ
��ҵ�ϻ����õ�ⷨ��ȡ![]() ��NaOH��Һ����
��NaOH��Һ����![]() ��Һ��pH��
��Һ��pH��![]() ����������
����������![]() ����ö��Ե缫��⡣�������в�����
����ö��Ե缫��⡣�������в�����![]() ��
��![]() ������������������
������������������![]() ���ٰѶ���������Ϊ��������
���ٰѶ���������Ϊ��������![]() ����
����![]() ����
����![]() �����ӷ���ʽΪ______��amol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ���Ϊ______��
�����ӷ���ʽΪ______��amol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ���Ϊ______��
![]() �����ɳ�������ִ��������й㷺��Ӧ�ã���䡢�ŵ練Ӧ���̰���ʽ���У�
�����ɳ�������ִ��������й㷺��Ӧ�ã���䡢�ŵ練Ӧ���̰���ʽ���У�![]()
![]()
![]() ��д���õ�س��ʱ�����ĵ缫��Ӧʽ______��
��д���õ�س��ʱ�����ĵ缫��Ӧʽ______��
���𰸡�![]() �ٽ�
�ٽ�![]() ˮ�������ȫ
ˮ�������ȫ ![]()
![]()
![]()
![]()
![]()
![]()
![]()
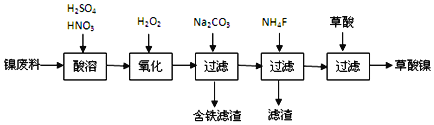
��������
�������̣�������![]() ���������ơ�þ�Ͻ�Ϊ��
���������ơ�þ�Ͻ�Ϊ��![]() ��ȡ������
��ȡ������![]() ���ٸ������ղ�������ȡ�����������������ϼ������ܽ����˵õ���Һ�к����������ӡ������ӡ�þ���ӡ������ӣ������������������������Ϊ�����ӣ�����̼������Һ������Һ��pH��ʹ������ȫ�����������˺����Һ�ڼ���
���ٸ������ղ�������ȡ�����������������ϼ������ܽ����˵õ���Һ�к����������ӡ������ӡ�þ���ӡ������ӣ������������������������Ϊ�����ӣ�����̼������Һ������Һ��pH��ʹ������ȫ�����������˺����Һ�ڼ���![]() ���������Ӻ�þ���ӣ����˵õ���Һ���������ӵ���Һ������Һ�м���������ɲ�����������Ũ������ȴ�ᾧ��������ΪĿ�����
���������Ӻ�þ���ӣ����˵õ���Һ���������ӵ���Һ������Һ�м���������ɲ�����������Ũ������ȴ�ᾧ��������ΪĿ�����![]() ��������
��������![]() ���ȿ����и�����ˮ��������������Сʱ���Ƶ�
���ȿ����и�����ˮ��������������Сʱ���Ƶ�![]() ��
��
![]() ��˫��ˮ��Ŀ��������Fe2+����
��˫��ˮ��Ŀ��������Fe2+����![]() ����Ӧ�����ӷ���ʽΪ��
����Ӧ�����ӷ���ʽΪ��![]() ������̼������Һ�������ǵ���pH���ٽ�������ˮ�������ȫ����֪��
������̼������Һ�������ǵ���pH���ٽ�������ˮ�������ȫ����֪��![]() ��
��![]() �����������
�����������![]() ��ȥ�����ӡ�þ���ӣ�������ҺΪ
��ȥ�����ӡ�þ���ӣ�������ҺΪ![]() ��
��![]() �ı�����Һ����
�ı�����Һ���� ��
��
�ʴ�Ϊ��![]() ���ٽ�
���ٽ�![]() ˮ�������ȫ��
ˮ�������ȫ��![]() ��
��
![]() ������
������![]() ���ȿ����и�����ˮ������
���ȿ����и�����ˮ������![]() ��
��![]() �ٷ���������ԭ��Ӧ��Ni��
�ٷ���������ԭ��Ӧ��Ni��![]() �����ߵ�
�����ߵ�![]() �ۣ���C��
�ۣ���C��![]() �۽��͵�
�۽��͵�![]() �ۣ�����Ҫ�����ɻ�����壬����һ����Ϊ
�ۣ�����Ҫ�����ɻ�����壬����һ����Ϊ![]() ����
����![]() ��CO��
��CO��![]() ���ʷ�ӦΪ��
���ʷ�ӦΪ��![]()
![]()
![]() ��
��
�ʴ�Ϊ��![]()
![]()
![]() ��
��
![]() ����
����![]() ����
����![]() ��
��![]() �����ӷ�ӦΪ��
�����ӷ�ӦΪ��![]() ��amol������ȫ��ת��Ϊ������ʱ�����뷴Ӧ��
��amol������ȫ��ת��Ϊ������ʱ�����뷴Ӧ��![]() ��Ϊ
��Ϊ![]() ����������в�����
��������������![]() ��
��![]() �����������ĵ缫��ӦΪ��
�����������ĵ缫��ӦΪ��![]() �������·��ͨ�����ӵ����ʵ���Ϊ
�������·��ͨ�����ӵ����ʵ���Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��
![]() ��֪��
��֪��![]()
![]()
![]() ����������ӦʽΪ��
����������ӦʽΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʫ�䡢������뻯ѧ�����йأ�˵������ȷ����
A. ��ˮ�齻�ڣ����Ͻ�����ǰ�߰��������仯�������߰�����ѧ�仯
B. �������з�ź������϶������˻�ѧ�仯
C. ����ˮʯ��������ľ������������ѧ�仯
D. �����Ʒ�ƽ�˾���ʵ����ӿ����������������ܽ�ƽ���״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
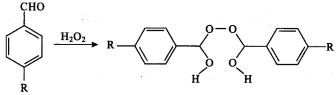
����Ŀ����֪��ȩ����˫��ˮ�ɷ������·�Ӧ��
Ϊ�˺ϳ�һ����ҩ��ѡ�������кϳ�·�ߣ�
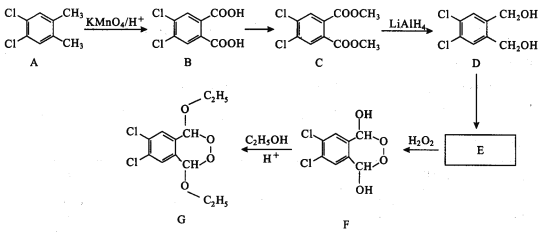
�ش��������⣺
(1)C�й����ŵ�������_______________________��
(2)E����F�ķ�Ӧ������_____________________��
(3)E�Ľṹ��ʽΪ______________________________��
(4)B����C�Ļ�ѧ����ʽΪ_____________________��
(5)��B��Ϊͬ���칹�����ڷ����Ԫ���ᣬ�Һ˴Ź�������Ϊ�����(�������Ϊ1��l)���л�����______�֡�
(6)�����Ҫ�Լ״��ͱ��״�Ϊԭ���Ʊ� 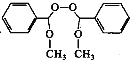 �ĺϳ�·��_________��
�ĺϳ�·��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������½������·�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)����H����373.2kJ��mol-1���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��(����)
N2(g)+2CO2(g)����H����373.2kJ��mol-1���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��(����)
A.�Ӵ���ͬʱ�����¶�B.�Ӵ���ͬʱ����ѹǿ
C.�����¶�ͬʱ����N2D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���Ե�Ʒ���(Cr2O3��CuO��Fe2O3��CaO)Ϊԭ����ȡͭ�ۺ�K2Cr2O7����Ҫ������ͼ��
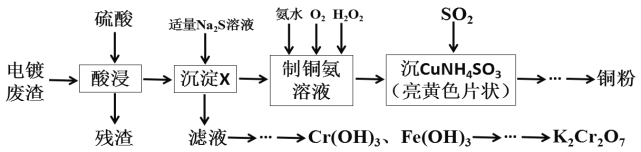
��1����������Na2S��Һ�����ɵij���XΪ___���������Na2S��Һ������������X��ᷢ����Ӧ�����ӷ���ʽΪ___��
��2������ƽ[Cu(NH3)4]SO4��H2O���ȷ����ֽⷴӦ�Ļ�ѧ����ʽ��
___[Cu(NH3)4]SO4��H2O![]() ___Cu+___NH3��+___SO2��+___N2��+___H2O
___Cu+___NH3��+___SO2��+___N2��+___H2O
��3������CuNH4SO3��ʱ������ͼװ��(�г֡�����������)��
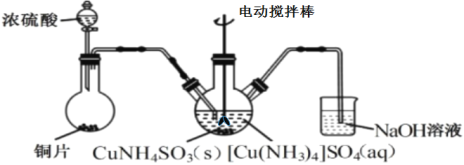
������CuNH4SO3��ʱ����Ӧ�¶��������45�棬���ʵļ��ȷ�ʽ��___��
��NaOH��Һ��������___��
��4���ⶨ��Ʒ��K2Cr2O7�����ķ������£���ȡ��Ʒ����2.0g���250mL��Һ��ȡ��25.00mL����ƿ�У���������ϡ�����ữ���ټ��뼸��ָʾ������0.1000mol/L���������(NH4)2Fe(SO4)2��Һ���еζ����ظ���������ʵ�顣(��֪Cr2O72-����ԭΪCr3+)
��������ʵ������(NH4)2Fe(SO4)2��Һ��ƽ�����Ϊ20.00mL�������ò�ƷK2Cr2O7�Ĵ���Ϊ___%��
������������K2Cr2O7����������ԭ��Ӧ��������Һ�г�����Cr3+��������һ��Ũ�ȵ�Fe3+����ͨ����pH�ķ���ʹ����ת��Ϊ�����������������ӳ�ʼŨ�Ⱦ�Ϊ2��10-3mo/L������Һ�иտ�ʼ����Cr(OH)3����ʱ��c(Fe3+)=___mo/L��{��֪��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�ԭ�ԣ��ܹ�������ͭ����������ͼ�е�װ�ÿ���ʵ�ָ÷�Ӧ����֪�����������ȵ�����ͭ��Ӧ�õ������ͽ���ͭ���ش��������⣺
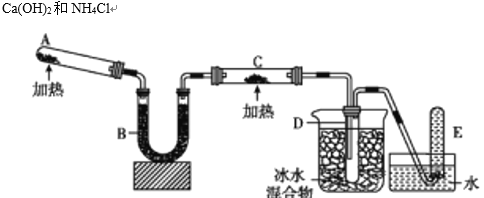
(1)д��A�з�Ӧ����ʽ��________________��
(2)д����������������ͭ�ķ�Ӧ����ʽ��________________��
(3)B�м���ĸ������________������ţ�
��Ũ���� ����ˮ�Ȼ��� �ۼ�ʯ��
(4)��֤����������ͭ��Ӧ��������C��________��
(5)D������ɫҺ�����ɡ�����D����ɫҺ��ijɷ�ʱ���õ�������һ��ҩƷ________������ţ�
A.![]() B.
B.![]() C.��ˮ����ͭ
C.��ˮ����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��d��e���ֶ�����Ԫ�ص�ԭ������������aΪ�ǽ���Ԫ����ԭ�Ӱ뾶��С��eΪ��������a��eͬ���壬c��dΪͬ���ڵ�����Ԫ�ء�eԭ�ӵ�����������c��dԭ������������֮�͡�bԭ���������������ڲ��������2����c����̬�⻯���������3�����ۼ������ƶϣ�
(1)д��dԪ�������ڱ��е�λ��________��
(2)c�ĵ��ʵķ���ʽΪ________��
(3)dԪ��������ͬ�������壬д����������ζ��һ�ֵķ���ʽ________��
(4)b�������̬�⻯��Ľṹʽ��________��
(5)d��e��ɵij����������ǵ���ɫ���壬д���û��������ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y���п������������ã�����X�Ƶá�
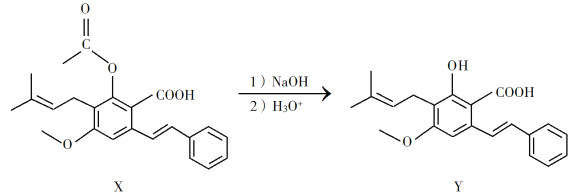
�����йػ�����X��Y��˵����ȷ����
A. 1 mol X�������2 mol NaOH��Ӧ
B. Y���Ҵ�����������Ӧ�ɵõ�X
C. X��Y����������KMnO4��Һ��Ӧ
D. ������X��Y�ֱ�������Br2�ӳɵIJ������������̼ԭ����Ŀ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ε�س䡢�ŵ�Ļ�ѧ����ʽΪ��2K2S2+KI3![]() K2S4+3KI���������豸���ӵĵ�·��ͼʾ�����պϿ���Kʱ��X������Һ�ȱ�죮������˵����ȷ����
K2S4+3KI���������豸���ӵĵ�·��ͼʾ�����պϿ���Kʱ��X������Һ�ȱ�죮������˵����ȷ����
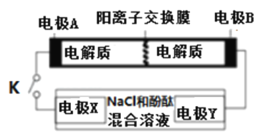
A.K+���ҵ���ͨ�������ӽ���Ĥ
B.A�ĵ缫��ӦʽΪ��3I����2e��=I3��
C.����0.1molK+ͨ�����ӽ���Ĥ��X�缫�ϲ�����״��������1.12L
D.��س��ʱ��B�缫Ҫ�����Դ�������������缫�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com