
【题目】阿伏伽德罗常数的值为NA。下列说法正确的是
A.18 g H2O、D2O组成的物质中含有的电子数为10NA
B.0.2 mol铁在足量的氧气中燃烧,转移电子数为0.6NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA个阳离子
【答案】D
【解析】
A. H2O、D2O分子中都含有10个电子,H2O相对分子质量是18,而D2O的相对分子质量为20,所以18 g两种分子构成的物质的物质的量小于1 mol,含有的电子数目小于10NA,A错误;
B. 铁在足量的氧气中燃烧生成Fe3O4,3 mol Fe反应转移8 mol电子,则0.2 mol Fe反应转移电子的物质的量为![]() ×8NA=0.53NA,B错误;
×8NA=0.53NA,B错误;
C. 浓盐酸与MnO2混合加热反应产生Cl2,每有4 mol HCl反应,转移2 mol电子,在该溶液中含HCl的物质的量 n(HCl)=cV=12 mol/L×0.05 L=0.6 mol,若盐酸中HCl完全反应,转移电子的物质的量为n(e-)=0.6 mol×![]() =0.3 mol,转移电子数目为0.3NA,但随着反应的进行浓盐酸会转变为稀盐酸,反应不再进行,因此转移电子数目小于0.3NA,C错误;
=0.3 mol,转移电子数目为0.3NA,但随着反应的进行浓盐酸会转变为稀盐酸,反应不再进行,因此转移电子数目小于0.3NA,C错误;
D. 0.1 mol熔融的KHSO4电离产生0.1 mol K+、0.1mol HSO4-,因此含有阳离子数目为0.1NA个,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】观察如图,回答问题:

(1)该装置叫__装置,可以将__能转化为__能。
(2)负极是__,电极反应式为__。
(3)正极是__,电极反应式为__。
(4)电池总反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁(III)酸钾晶体[K3[Fe(C2O4)3]·3H2O]是制备负载型活性铁催化剂的主要原料。某科研团队以硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]为原料制备草酸合铁(III)酸钾晶体的具体流程如图:
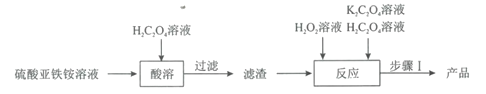
回答下列问题:
(1)配制100mL1.00mol·L-1的硫酸亚铁铵溶液。溶液配制过程中需用到的玻璃仪器除烧杯、玻璃棒、量筒外,还有___。在配制时需加入适量稀硫酸的目的是___。
(2)取12.5mL硫酸亚铁铵溶液于烧杯中,水浴加热至100℃,缓缓滴入饱和H2C2O4溶液,有黄色沉淀(FeC2O4·2H2O)生成,反应的离子方程式为___。
(3)在“酸溶”操作中,需保持溶液的pH为3.5,溶液中![]() =___。(H2C2O4的Ka1=10-1.25,Ka2=10-4.27)。
=___。(H2C2O4的Ka1=10-1.25,Ka2=10-4.27)。
(4)在“反应”中,先维持40℃水浴加热,滴加10mL6%H2O2溶液,一段时间后,再微沸2min;然后冷却,继续交替滴加H2C2O4和K2C2O4溶液直至溶液呈亮绿色。维持40℃水浴加热使最终所得产品产率最高的原因是__,溶液微沸的目的是__。
(5)经“步骤I”结晶、抽滤、洗涤、避光干燥,最终得到产品5.45g,产品的产率为____(保留1位小数)。
(6)草酸合铁(I)酸钾晶体为光敏配合物,应避光保存,光照时会发生光化学分解反应生成草酸钾和草酸亚铁,同时有气体生成,反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) ![]() bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:________________________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol钠和1mol铝的混合物小心地投入932g水中,充分反应,计算:
(1)生成气体的质量为多少______?
(2)溶液中有几种溶质______?
(3)各溶质的质量分数为多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铝铵[Ala(NH4)b(SO4)c.xH2O]又叫做明矾、宝石明矾,其相对分子质量为906,常用作净水剂和制造人工刚玉(γ-Al2O3)
(1)[Ala(NH4)b(SO4)c.xH2O]中a、b、c的代数关系式是_________。
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体的分子式是_______。
(3)为确定硫酸铝铵的组成,进行如下实验:
①明确称取4.530g样品与足量氯化钡溶液充分反应,生成白色沉淀4.660g
②另取4.530g样品在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如图所示:
×100%)随温度的变化如图所示:
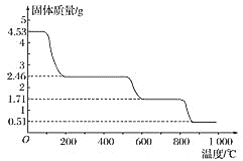
根据以上实验数据计算硫酸铝铵的分子式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的硫酸亚铁固体,利用下图装置进行实验。
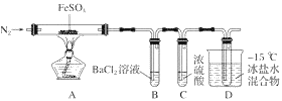
实验过程及现象如下:
①通一段时间氮气后加热,A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体;
②用带火星的木条靠近装置D的导管口,木条复燃;
③充分反应后停止加热,冷却后取A中固体,加盐酸,固体溶解,溶液呈黄色;
④将③所得溶液滴入D试管中,溶液变为浅绿色。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是__________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_________。
(3)实验④反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
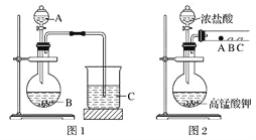
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com