
【题目】硫酸铝铵[Ala(NH4)b(SO4)c.xH2O]又叫做明矾、宝石明矾,其相对分子质量为906,常用作净水剂和制造人工刚玉(γ-Al2O3)
(1)[Ala(NH4)b(SO4)c.xH2O]中a、b、c的代数关系式是_________。
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体的分子式是_______。
(3)为确定硫酸铝铵的组成,进行如下实验:
①明确称取4.530g样品与足量氯化钡溶液充分反应,生成白色沉淀4.660g
②另取4.530g样品在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如图所示:
×100%)随温度的变化如图所示:
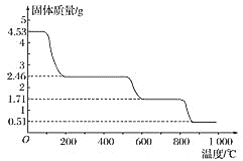
根据以上实验数据计算硫酸铝铵的分子式_____。
【答案】3a+b=2c SO3 Al2(NH4)2(SO4)4·24H2O
【解析】
(1)依据元素化合价代数和计算分析a、b、c的代数关系式;
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体,根据反应前后元素化合价不变,可知硫酸盐分解生成金属氧化物和三氧化硫;
(3)先计算硫酸铝铵晶体物质的量,反应后的沉淀为硫酸钡,计算物质的量得到硫酸根离子物质的量,依据图象分析计算氧化铝物质的量,结合化合价代数和为0计算得到b,依据相对分子质量计算x,据此确定化学式。
(1)[Ala(NH4)b(SO4)c.xH2O]中的Ala(NH4)b(SO4)c元素化合价代数和为0得到: 3a+b+(-2c)=0,a、b、c的代数关系式为:3a+b=2c;
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体,根据反应前后元素化合价不变,可知硫酸盐分解生成金属氧化物和三氧化硫,所以另一种气体是硫元素化合价为+6价的SO3;
(3)4.53g硫酸铝铵晶体的物质的量n[Ala(NH4)b(SO4)c.xH2O]=![]() =0.005mol,n(SO42-)=
=0.005mol,n(SO42-)=![]() =0.02mol,c=
=0.02mol,c=![]() =4,加热到最后得到固体为Al2O3,氧化铝的含量为:
=4,加热到最后得到固体为Al2O3,氧化铝的含量为:![]() ×100%=11.26%,n(Al2O3)=
×100%=11.26%,n(Al2O3)=![]() =0.005 mol,a=
=0.005 mol,a=![]() =2,根据电荷守恒3a+b=2c,b=2×4-3×2=2,根据物质相对分子质量为906可知x=
=2,根据电荷守恒3a+b=2c,b=2×4-3×2=2,根据物质相对分子质量为906可知x=![]() =24,故硫酸铝铵的分子式:Al2(NH4)2(SO4)4·24H2O。
=24,故硫酸铝铵的分子式:Al2(NH4)2(SO4)4·24H2O。


科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:

(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数的值为NA。下列说法正确的是
A.18 g H2O、D2O组成的物质中含有的电子数为10NA
B.0.2 mol铁在足量的氧气中燃烧,转移电子数为0.6NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100ml同物质的量浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定):
① | ② | ③ | ④ | |
铝热剂质量/g | 5g | 10g | 15g | 20g |
气体体积/L | 2.24L | 4.48L | 6.72L | 6.72L |
试完成下列计算:
(1)NaOH溶液的物质的量浓度_______________。
(2)该铝热剂中铝的质量分数_____________
(3)20g该铝热剂发生铝热反应理论上产生铁的质量是多少?________(写出步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①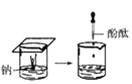 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②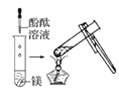 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③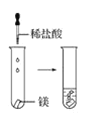 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④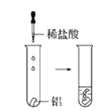 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为___。
(2)已知下列热化学方程式
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -25kJ·mol-1 ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -47kJ·mol-1 ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= +19kJ·mol-1 ③写出FeO(s)被CO还原成Fe和CO2的热化学方程式____。
(3)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com