
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
【答案】c e b ab 蒸发 过滤 产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体 a
【解析】
(1)根据固体加热分析,用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却;
(2)根据氧化铜和铜的性质分析,铜在加热条件下易生成氧化铜,氧化铜稳定,难以分解;
(3)由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体;
(4)途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体;
(5)a.加热温度过高,会导致硫酸铜分解,质量变化较大;
b.胆矾晶体的颗粒较大,会导致晶体解热分解不完全,质量变化偏小,结果偏小;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小;
d.胆矾晶体部分风化,会使水的含量较小,结果偏小. 在灼烧过程中铜可被空气氧化;
(1)用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却,
故答案为:c;e;b;
(2) 在灼烧过程中铜可被空气氧化,但生成的氧化铜也可被有机物还原,铜在加热条件下易生成氧化铜,氧化铜稳定,难以分解, a、b项正确,
故答案为:ab;
(3)由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体,
故答案为:蒸发;过滤;
(4)途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体,
故答案为:产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体;
(5)a.加热温度过高,会导致硫酸铜分解,质量变化较大,导致结果偏大,故a符合题意;
b.胆矾晶体的颗粒较大,会导致晶体受热分解不完全,质量变化偏小,结果偏小,故b不符合题意;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小,故c不符合题意;
d.胆矾晶体部分风化,会使水的含量较小,结果偏小,故d不符合题意;
故答案选a。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是常用的消毒剂,易溶于水、易挥发、见光或受热易分解。制备原理为:H2O2+CH3COOH![]() CH3COOOH+H2O △H<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
CH3COOOH+H2O △H<0,制得的过氧乙酸(含少量H2O2)含量测定流程如下,下列说法不正确的是( )
![]()
A.应在密闭、低温、避光条件下保存过氧乙酸
B.在常压条件下采用蒸馏操作将过氧乙酸分离出来
C.溶液由无色变为浅红色且30s内不变色,说明H2O2已除尽
D.加过量硫酸亚铁溶液目的是还原CH3COOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
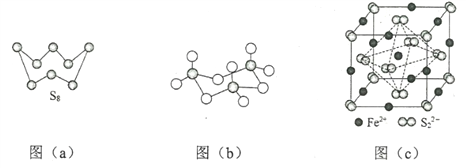
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
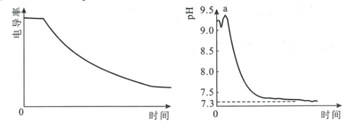
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) ![]() bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:________________________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氯芬酸钠(G)是常用的抗炎镇痛药,一种合成路线如图(-Ph为苯基):
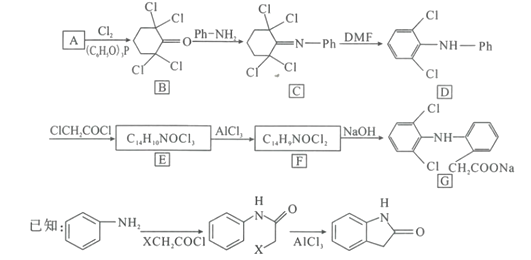
回答下列问题:
(1)9.8gA完全燃烧生成26.4gCO2和9.0gH2O,且A的核磁共振氢谱中有3组峰,峰面积之比为1:2:2,则A的结构简式是___。
(2)B中的官能团名称是___。
(3)E到F的反应类型是___。
(4)写出F到G的反应方程式___。
(5)能发生银镜反应且为环状结构的A的同分异构体多达14种,写出其中只含一条侧链且侧链上的一氯代物为2种的结构简式___(不考虑立体异构)。
(6)设计由2—丙醇和对苯二胺(![]() )制备
)制备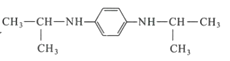 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铝铵[Ala(NH4)b(SO4)c.xH2O]又叫做明矾、宝石明矾,其相对分子质量为906,常用作净水剂和制造人工刚玉(γ-Al2O3)
(1)[Ala(NH4)b(SO4)c.xH2O]中a、b、c的代数关系式是_________。
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体的分子式是_______。
(3)为确定硫酸铝铵的组成,进行如下实验:
①明确称取4.530g样品与足量氯化钡溶液充分反应,生成白色沉淀4.660g
②另取4.530g样品在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如图所示:
×100%)随温度的变化如图所示:
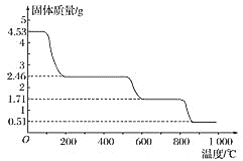
根据以上实验数据计算硫酸铝铵的分子式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现其合理利用。反应Ⅰ:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
(1)己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、B kJ/mol, H2O(l)=H2O(g) △H =+C kJ/mol。计算反应Ⅰ的△H=_______kJ/mol。
(2)将原料气按n(CO2)∶n(H2)=1:4置于密闭容器中发生反应Ⅰ,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
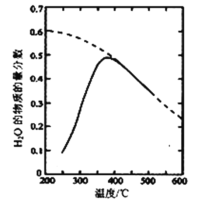
①温度过高或过低均不利于该反应的进行,原因是________。
②200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为____。(不必化简。用平衡分压代替平衡浓度计算)
(3)一种新的利用方案是Ⅱ:反应:CO2(g)+2H2(g)![]() C(s)+2H2O(g) △H
C(s)+2H2O(g) △H
①向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol H2和0.04 mol CO2发生反应Ⅱ。若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图1曲线a所示,则△H___ 0(填“>”“<”或“不确定”)
②若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图1曲线b所示,则改变的条件是_______。
③图2是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是_______(填“甲”或“乙”),m值为______。
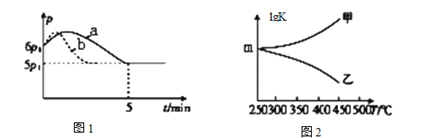
④反应Ⅱ必须在高温下才能启动,原因是______________。
(4)科学家还研究了处理CO2(g)另外的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为______________。
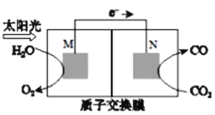
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
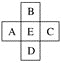
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com