
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
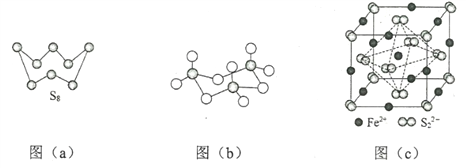
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
【答案】 ![]() 哑铃(纺锤) H2S S8相对分子质量大,分子间范德华力强 平面三角 2 sp3
哑铃(纺锤) H2S S8相对分子质量大,分子间范德华力强 平面三角 2 sp3 ![]()
![]()
【解析】分析:(1)根据铁、硫的核外电子排布式解答;
(2)根据价层电子对互斥理论分析;
(3)根据影响分子晶体熔沸点高低的是分子间范德华力判断;
(4)根据价层电子对互斥理论分析;
(5)根据晶胞结构、结合密度表达式计算。
详解:(1)基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,则其价层电子的电子排布图(轨道表达式)为![]() ;基态S原子的核外电子排布式为1s22s22p63s23p4,则电子占据最高能级是3p,其电子云轮廓图为哑铃(纺锤)形。
;基态S原子的核外电子排布式为1s22s22p63s23p4,则电子占据最高能级是3p,其电子云轮廓图为哑铃(纺锤)形。
(2)根据价层电子对互斥理论可知H2S、SO2、SO3的气态分子中,中心原子价层电子对数分别是![]() ,因此不同其他分子的是H2S。
,因此不同其他分子的是H2S。
(3)S8、二氧化硫形成的晶体均是分子晶体,由于S8相对分子质量大,分子间范德华力强,所以其熔点和沸点要比二氧化硫的熔点和沸点高很多;
(4)气态三氧化硫以单分子形式存在,根据(2)中分析可知中心原子含有的价层电子对数是3,且不存在孤对电子,所以其分子的立体构型为平面三角形。分子中存在氧硫双键,因此其中共价键的类型有2种,即σ键、π键;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子形成4个共价键,因此其杂化轨道类型为sp3。
(5)根据晶胞结构可知含有铁原子的个数是12×1/4+1=4,硫原子个数是8×1/8+6×1/2=4,晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,则其晶体密度的计算表达式为![]() ;晶胞中Fe2+位于
;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长是面对角线的一半,则为
所形成的正八面体的体心,该正八面体的边长是面对角线的一半,则为![]() nm。
nm。


科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法不正确的是( )
A.焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验
B.定容时,因不慎使液面高于容量瓶的刻度线,可用胶头滴管将多余液体吸出
C.萃取后进行分液操作时,下层液体放出后,上层液体应从上口倒出
D.蒸馏操作时,温度计的水银球应处于蒸馏烧瓶支管口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA) D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023
B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C. 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数不同
D. 2.24L CO2中含有的原子数为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_________________。
(3)与N3-互为等电子体的分子为_________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________,其中心原子杂化类型是__________。
(4)叠氮化钠中不含有的化学键类型有_____________。
A.离子键 B.极性共价键 C.σ键 D.π键
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiS04、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):
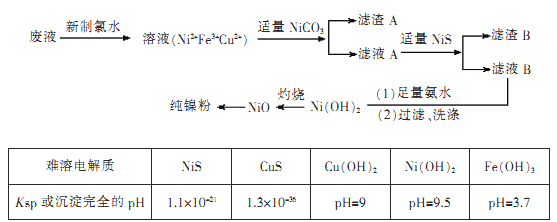
注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为____
(2)加入NiCO3的目的是________。
(3)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全角度评价两种方案的优点。
方案1.____
方案2.____
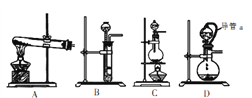
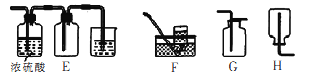
(4)方案2所用的氢气可以选用下列装置中的____来制取(填写字母,下同),收集氢气可选用装置________。
(5)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的____。装置D中导管a的作用是____。
a.CO2 b.Cl2 c.NO d.SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com