
【题目】高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiS04、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):
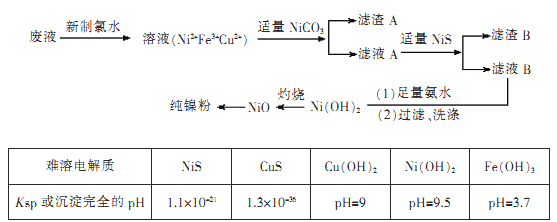
注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为____
(2)加入NiCO3的目的是________。
(3)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全角度评价两种方案的优点。
方案1.____
方案2.____
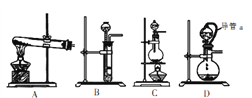
(4)方案2所用的氢气可以选用下列装置中的____来制取(填写字母,下同),收集氢气可选用装置________。
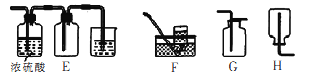
(5)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的____。装置D中导管a的作用是____。
a.CO2 b.Cl2 c.NO d.SO2
【答案】 Cl2+2Fe2+===2Fe3++2Cl- 调节溶液pH=3.7,使溶液中的Fe3+完全变成Fe(OH)3沉淀而除去 方案1:节省原料、实验安全 方案2:产品纯度较高 BD FH a d 平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下
【解析】(1)分析题给流程知电镀废液加入新制氯水Fe2+被氧化为Fe3+,发生反应的离子方程式为Cl2+2Fe2+===2Fe3++2Cl-;(2)结合题给工艺流程和信息知加入NiCO3的目的是调节溶液pH=3.7,使溶液中的 Fe3+完全变成Fe(OH)3沉淀而除去;(3)方案1:操作简便、节省原料、实验安全。方案2:产品纯度较高;(4)锌与稀硫酸反应制备氢气为固体和液体不加热制备气体,可选用装置中的BD来制取;氢气难溶于水,可用排水法收集,氢气密度比空气小且与空气中的成分不反应,可用向下排空气法收集,故收集氢气可选用FH装置;(5)根据装置D装置和E装置的特点及气体的性质分析,该装置反应装置适用于制备固体与液体不加热反应制气体,可制取并收集干燥纯净的二氧化碳和二氧化硫,答案选ad;装置D中导管a的作用是平衡分液漏斗和烧瓶中的气压,便于分液漏斗中液体顺利流下。


科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
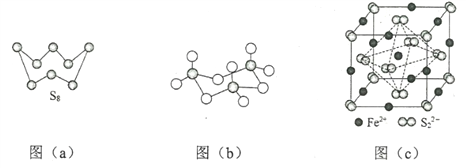
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 测得0. Imol/L氨水的pH为11: ![]()
B. 用NaCl溶液做铁的吸氧腐蚀实验,O2减少:![]()
C. 用H2、O2进行氢氧燃料电池实验,产生电流:![]()
D. 用NH4Cl溶液溶解Mg(OH)2,沉淀溶解![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是

A. 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. 点②所示溶液中:c(H+)>c(Cl-)>c(ClO—)>c(HClO)
C. 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制氨气常用以下两种方法:
①用固体氢氧化钙与氯化铵晶体反应制取;
②用固体生石灰与浓氨水混合制取。
请回答下列问题:
(1)写出方法①的化学方程式_______________。
(2)方法②能制取氨气的原理是___________________。
(3)检验氨气是否收集满的方法是______________________。
(4)通常用于证明氨气极易溶于水的实验是______________;氨水显碱性的原因是_____________。
(5)制备氨气的装置如下,方法①应选用_________(填字母,下同),方法②应选用__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. MgCl2的摩尔质量为95g
B. 18g H2O含有的原子总数为3NA
C. 0.5mol H2所占体积约为11.2L
D. 0.1 mol·L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com