
【题目】下列解释事实的方程式不正确的是
A. 测得0. Imol/L氨水的pH为11: ![]()
B. 用NaCl溶液做铁的吸氧腐蚀实验,O2减少:![]()
C. 用H2、O2进行氢氧燃料电池实验,产生电流:![]()
D. 用NH4Cl溶液溶解Mg(OH)2,沉淀溶解![]()
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023
B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C. 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数不同
D. 2.24L CO2中含有的原子数为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_________________。
(3)与N3-互为等电子体的分子为_________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________,其中心原子杂化类型是__________。
(4)叠氮化钠中不含有的化学键类型有_____________。
A.离子键 B.极性共价键 C.σ键 D.π键
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____________________________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
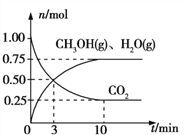
①反应的化学方程式为:____________________________________________________。
②从反应开始到平衡,氢气的平均反应速率v(H2)=_____________mol/(Lmin)。
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示: [p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示: [p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
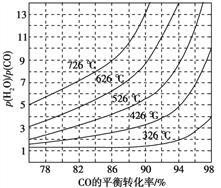
①上述反应的逆反应方向是_____________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),,则该反应的Kp=______________,提高![]()
![]() ,则Kp_____________(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,则Kp_____________(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]()
![]() =3~5,采用此条件的原因可能是______________________________________________________________________。
=3~5,采用此条件的原因可能是______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作正确的是
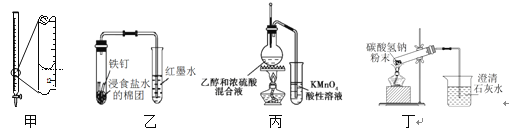
A. 装置甲液面读数为12.20 mL B. 装置乙可探究铁的吸氧腐蚀
C. 装置丙可检验乙烯的生成 D. 装置丁可验证碳酸氢钠受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液的说法正确的是
A. 向AgCl、AgBr的混合饱和溶液中加入少量AgNO3固体,溶液中![]() 不变
不变
B. 将CH3COONa溶液从20C升温至30C,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 同0.1mol/LCH3COOH溶液中加入少量水.溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiS04、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):
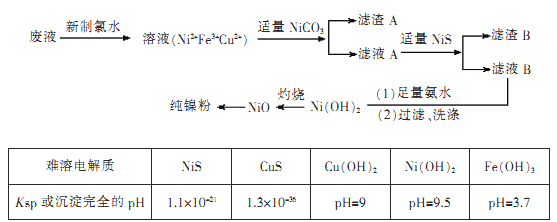
注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为____
(2)加入NiCO3的目的是________。
(3)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全角度评价两种方案的优点。
方案1.____
方案2.____
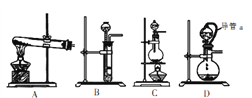
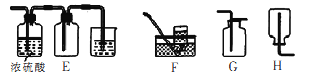
(4)方案2所用的氢气可以选用下列装置中的____来制取(填写字母,下同),收集氢气可选用装置________。
(5)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的____。装置D中导管a的作用是____。
a.CO2 b.Cl2 c.NO d.SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com