
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____________________________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L的密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
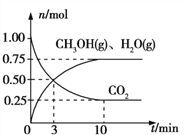
①反应的化学方程式为:____________________________________________________。
②从反应开始到平衡,氢气的平均反应速率v(H2)=_____________mol/(Lmin)。
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示: [p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示: [p(H2O)、p(CO)表示H2O、CO的平衡分压,分压=总压×物质的量分数]:
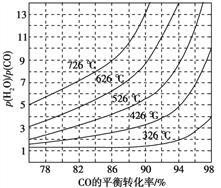
①上述反应的逆反应方向是_____________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),,则该反应的Kp=______________,提高![]()
![]() ,则Kp_____________(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,则Kp_____________(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]()
![]() =3~5,采用此条件的原因可能是______________________________________________________________________。
=3~5,采用此条件的原因可能是______________________________________________________________________。
【答案】 CO2(g)+4H2(g)![]() CH4(g)+2H2O(g);ΔH=-162kJmol-1 CO2+3H2
CH4(g)+2H2O(g);ΔH=-162kJmol-1 CO2+3H2![]() CH3OH+H2O 0.1125 吸热
CH3OH+H2O 0.1125 吸热 ![]() 不变 投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右
不变 投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右
【解析】(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH1=-41 kJ·mol-1
H2(g)+CO2(g) ΔH1=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH2=-73 kJ·mol-1
CH4(g) ΔH2=-73 kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1
根据盖斯定律,由③-2×①+②得反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g);ΔH=ΔH3-2×ΔH1+ΔH2=-171 kJ·mol-1-2×(-41 kJ·mol-1)+(-73 kJ·mol-1)=-162kJmol-1;(2) ①根据图中曲线信息可知,v(CO2)=
CH4(g)+2H2O(g);ΔH=ΔH3-2×ΔH1+ΔH2=-171 kJ·mol-1-2×(-41 kJ·mol-1)+(-73 kJ·mol-1)=-162kJmol-1;(2) ①根据图中曲线信息可知,v(CO2)=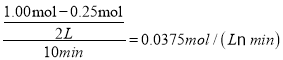 、v(H2O)=v(CH3OH)=
、v(H2O)=v(CH3OH)=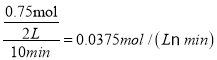 ,根据化学反应速率之比等于反应方程式的计量数之比可知反应中CO2、CH3OH(g)和H2O(g)的系数均为1,结合化学方程式配平可得反应的化学方程式为:CO2+3H2
,根据化学反应速率之比等于反应方程式的计量数之比可知反应中CO2、CH3OH(g)和H2O(g)的系数均为1,结合化学方程式配平可得反应的化学方程式为:CO2+3H2![]() CH3OH+H2O;②根据反应速率之比等于计量数之比,从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CO2)=
CH3OH+H2O;②根据反应速率之比等于计量数之比,从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CO2)=![]() ;(3)①由图可知p(H2O)/p(CO)相同时温度越高CO的平衡转化率越小,说明升高温度平衡向逆反应方向移动,则逆反应为吸热反应;②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
;(3)①由图可知p(H2O)/p(CO)相同时温度越高CO的平衡转化率越小,说明升高温度平衡向逆反应方向移动,则逆反应为吸热反应;②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=![]() ;平衡常数只与温度有关,与浓度无关,所以提高
;平衡常数只与温度有关,与浓度无关,所以提高![]() 比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右,
比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右, ![]() =3~5。
=3~5。


科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应发生在同种元素之间的是( )
A. Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
B. 2H2S+SO2![]() 3S↓+2H2O
3S↓+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。某兴趣小组用右图模拟该电池工作原理。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。请填空:
2K2CO3+6H2O。请填空:
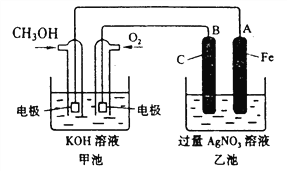
(1)充电时:①原电池的负极与电源_______极相连。
②阳极的电极反应式为____________________________________________。
(2)放电时:负极的电极反应式为_______________________________________________。
(3)某兴趣小组的同学用如图装置进行如下实验:在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2 的体积为________L(标准状况下)。
(4)已知常温时CuS的Ksp=1.3×10-36,向100 mL 2×10-18 mol·L-1的K2S溶液中加入100 mL 2×10-18 mol·L-1的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 测得0. Imol/L氨水的pH为11: ![]()
B. 用NaCl溶液做铁的吸氧腐蚀实验,O2减少:![]()
C. 用H2、O2进行氢氧燃料电池实验,产生电流:![]()
D. 用NH4Cl溶液溶解Mg(OH)2,沉淀溶解![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
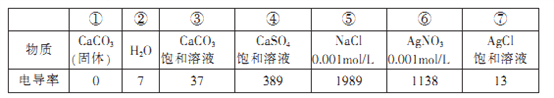
下列分析不正确的是
A. CaCO3固体中不存在白由移动的离子
B. 与②对比,说明⑦中存在:AgCl=Ag++ Cl-
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com