
【题目】NOx、SO2的处理转化对环境保护有着重要意义。
(1) 利用反应2NO(g)+2CO(g) N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=![]() ]的关系如图1所示。
]的关系如图1所示。

①该反应的ΔH________(填“>”“<”或“=”)0。
②下列说法正确的是________(填字母)。
A. 当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B. 投料比:m1>m2>m3
C. 当投料比m=2时,NO转化率是CO转化率的2倍
D. 汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为________。
(2) 若反应2NO(g)+2CO(g) N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1 L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=________。
(3) 工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298 K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数![]() 的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。

下列说法正确的是________(填字母)。
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COSS2+2CO;4CO2+S24CO+2SO2
(4) NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝除技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为________。

(5) 用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为________。
【答案】< AB 温度较高时,温度变化对平衡移动的影响大于浓度变化对平衡移动的影响 160 ACD 4NH3+4NO+O2![]() 4N2+6H2O 2SO32-+4H++2e-===S2O42-+2H2O
4N2+6H2O 2SO32-+4H++2e-===S2O42-+2H2O
【解析】
(1)①结合图1所示温度对一氧化碳转化率的影响分析判断该反应正反应是放热还是吸热;
②A.反应达到平衡状态时,体系内各组分的含量保持不变;
B.结合图1,控制变量法分析,投料比的大小;
C.m=![]() ,根据比例关系,结合方程式分析判断;
,根据比例关系,结合方程式分析判断;
D.催化剂只改变反应速率,不影响平衡移动;
③温度和浓度都是影响平衡移动的外界因素;
(2) 结合图2,a点时c(CO2)= c (CO),结合三段式,根据公式计算;
(3) A.根据图4中含氮元素、硫元素的物质种类分析;
B.根据图4二氧化硫的曲线升高分析;
C.根据图3中曲线斜率大小分析;
D.根据图4 COS曲线随温度变化,分析体系中可能发生反应;
(4)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式;
(5)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子。
(1)①根据图1所示,温度升高,一氧化碳平衡转化率降低,平衡逆向移动,则正反应为放热反应,ΔH<0;
②A.反应达到平衡状态时,体系内各组分的含量保持不变,![]() 比值不变,反应达到平衡,故A正确;
比值不变,反应达到平衡,故A正确;
B.结合图1,相同温度下,按m1投料比时,一氧化碳的转化率最大,即一氧化氮的投入量越多,![]() 比值越大,则m1>m2>m3;
比值越大,则m1>m2>m3;
C.根据反应2NO(g)+2CO(g) N2(g)+2CO2(g),按![]() =1投料平衡时,NO转化率和CO转化率相等,当投料比m=2时,
=1投料平衡时,NO转化率和CO转化率相等,当投料比m=2时,![]() =2, 可看做在1:1投料的基础上增加NO的投料,平衡正向移动,CO转化率增大,NO转化率减小,故C错误;
=2, 可看做在1:1投料的基础上增加NO的投料,平衡正向移动,CO转化率增大,NO转化率减小,故C错误;
D.催化剂只改变反应速率,不影响平衡移动,NO的平衡转化率不变,故D错误;
答案选AB;
③温度较低时,反应物的投料比(反应物的浓度)是影响平衡移动的主要因素;该可逆反应为放热反应,当温度较高时,反应逆向进行的趋势增大,温度变化对平衡移动的影响大于浓度变化对平衡移动的影响,不论以何种投料比,一氧化碳的转化率都减小;
(2)由图2a点可得,c(CO2)=c(CO),设反应进行到a点时,c(CO2)=c(CO)=x,列“三段式”:
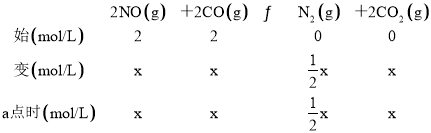
x=1,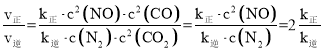 =2 K正
=2 K正
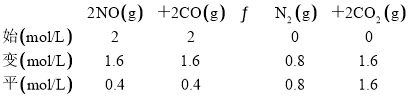
K正=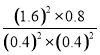 =80,则
=80,则![]() =2 K正=2×80=160;
=2 K正=2×80=160;
(3) A.根据图4中随着温度升高,含氮元素的物质只有N2,则脱硝的产物为N2,随着温度的升高,含硫元素的物质COS或S2,则脱硫的产物随温度变化可能有多种,故A正确;
B.根据图4,温度升高,二氧化硫的曲线上升,二氧化硫分压增大,则脱硫效率降低,故B错误;
C.根据图3,随CO物质的量分数增大,还原NOx生成N2曲线斜率变化较小,而还原SO2需要CO物质的量分数较大时才能将SO2从烟气中分离,说明CO更易于NOx反应,则
D.根据图4,COS分压曲线随温度升高减小,CO、S2分压增大,可能发生反应2COSS2+2CO,继续升高温度,CO2、S2分压减小,CO分压增大,可能发生反应4CO2+S24CO+2SO2,故D正确;
答案选ACD;
(4) 用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2![]() 4N2+6H2O;
4N2+6H2O;
(5) 阴极发生还原反应,是亚硫酸根离子,得电子,生成硫代硫酸根离子,电极反应式为:2SO32-+4H++2e-=S2O42-+2H2O。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 若向平衡体系中加入少量C,则正、逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4水溶液中部分微粒的分布分数δ与pH关系如图所示,下列说法正确的是

A.向H2C2O4溶液中滴加NaOH溶液至pH=2.5:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.由图可知:H2C2O4的Ka2=10-4.2
C.向H2C2O4溶液中滴加NaOH溶液至pH=7,则溶液中:2c(C2O42-)>c(Na+)
D.将0.01 mol·L-1的H2C2O4溶液与0.02 mol·L-1 NaOH溶液等体积混合后的溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,在大脑内传递兴奋的信息,其分子结构如下所示。下列关于多巴胺的说法不正确的是

A. 分子式为C8H11NO2
B. 能与醛类物质发生缩聚反应
C. 既能与酸反应,又能与碱反应
D. 1mol该物质最多能与2mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。该有机物的分子式为______。
Ⅱ.为了证明溴乙烷中存在溴原子,某同学设计如下实验:
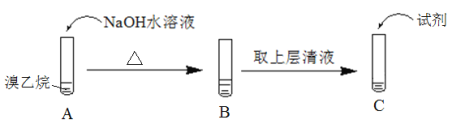
①将试管C中加入的试剂及相应的实验现象补充完整:_________。
②溴乙烷在NaOH水溶液中反应的化学方程式是_____________。
Ⅲ.为实现以下各步转化,请在下列括号中填入适当试剂。______、______
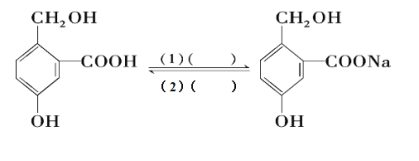
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2molA气体和2molB气体后发生如下反应:![]() ,反应达到平衡状态时生成1molC气体,放出热量
,反应达到平衡状态时生成1molC气体,放出热量![]() ;乙中加入1molC气体,反应达到平衡时,吸收热量
;乙中加入1molC气体,反应达到平衡时,吸收热量![]() ,则
,则![]() 与
与![]() 的相互关系正确的是( )
的相互关系正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入1molN2和3molH2,发生下列反应:N2(g)+3H2(g)2NH3(g),反应达到平衡后,改变下述条件,NH3气体平衡浓度不改变的是( )
A.保持温度和容器压强不变,充入1molNH3(g)
B.保持温度和容器体积不变,充入1molNH3(g)
C.保持温度和容器压强不变,充入1molN2(g)
D.保持温度和容器压强不变,充入1molAr(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
a.配制![]() 食盐溶液时,将称量的食盐放入烧杯中,加适量的水,搅拌、溶解
食盐溶液时,将称量的食盐放入烧杯中,加适量的水,搅拌、溶解
b.用50mL量筒量取![]() 稀硫酸
稀硫酸
c.用中和滴定法测定某NaOH溶液的浓度时,酸式滴定管需用标准酸液润洗![]() 次
次
d.配制![]() 的
的![]() 溶液时,将量取的浓
溶液时,将量取的浓![]() 注入容量瓶中加水稀释
注入容量瓶中加水稀释
e.用瓷坩埚灼烧各种钠的化合物
f.测定中和反应的反应热时,利用玻璃搅拌器匀速搅拌.
A.adfB.bdeC.acfD.cef
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com