
【题目】Ⅰ.某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。该有机物的分子式为______。
Ⅱ.为了证明溴乙烷中存在溴原子,某同学设计如下实验:
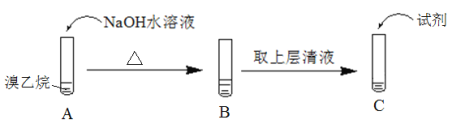
①将试管C中加入的试剂及相应的实验现象补充完整:_________。
②溴乙烷在NaOH水溶液中反应的化学方程式是_____________。
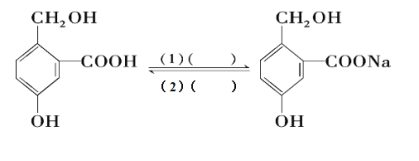
Ⅲ.为实现以下各步转化,请在下列括号中填入适当试剂。______、______
【答案】C8H10 加入足量稀HNO3调至酸性,再加入AgNO3溶液,有浅黄色沉淀生成 CH3CH2Br+NaOH![]() CH3CH2OH+NaBr NaHCO3溶液 稀HCl或稀H2SO4
CH3CH2OH+NaBr NaHCO3溶液 稀HCl或稀H2SO4
【解析】
I.浓硫酸增重9g,是吸收的水蒸气的质量,氢氧化钠溶液增重35.2g,是吸收的二氧化碳的质量,计算出生成的水和二氧化碳的物质的量,再结合原子守恒分析判断1个分子中含有的C和H,确定化学式;
II.溴乙烷在NaOH水溶液发生水解生成乙醇、NaBr,需要在试管C中检验溴离子;
Ⅲ.-COOH与Na、NaOH、Na2CO3、NaHCO3反应可以转化为-COONa,结合醇羟基和酚羟基的性质分析;-COONa与酸性比—COOH强的酸反应可以转化为-COOH。
I.浓硫酸增重9g,是吸收的水蒸气的质量,n(H2O)=![]() =0.5mol,氢氧化钠溶液增重35.2g, 是吸收的二氧化碳的质量,n(CO2)=
=0.5mol,氢氧化钠溶液增重35.2g, 是吸收的二氧化碳的质量,n(CO2)=![]() =0.8mol,由原子守恒可知,则该苯的同系物中含C原子为
=0.8mol,由原子守恒可知,则该苯的同系物中含C原子为![]() =8,含H原子为
=8,含H原子为![]() =10,分子式为C8H10,故答案为:C8H10;
=10,分子式为C8H10,故答案为:C8H10;
II.①要证明溴乙烷中存在溴原子,需要在试管C中加入足量稀硝酸至酸性,再加硝酸银溶液,有浅黄色沉淀生成,即可证明溴乙烷中存在溴原子,故答案为:加入足量稀硝酸至酸性,再加硝酸银溶液,有浅黄色沉淀生成;
②溴乙烷在NaOH水溶液中发生水解反应,反应的化学方程式是CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH
CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr;
CH3CH2OH+NaBr;
Ⅲ.由官能团变化可知,(1)的转化中醇羟基和酚羟基没有变化,则实现(1)的转化加入NaHCO3与-COOH反应;发生强酸制取弱酸的反应可实现(2)的转化,则试剂(1)为碳酸氢钠溶液,试剂(2)为稀盐酸或稀硫酸,故答案为:碳酸氢钠溶液;稀盐酸或稀硫酸。


科目:高中化学 来源: 题型:
【题目】镇咳药沐舒坦可由化合物甲和化合物乙在一定条件下制得:
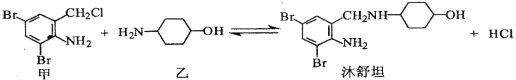
下列有关叙述正确的是( )
A. 甲的分子式为C7H4NBr2Cl
B. 沐舒坦分子中最多有13个碳原子共平面
C. 乙遇FeCl3溶液显紫色
D. 反应过程中加入适量K2CO3可提高沐舒坦的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空:
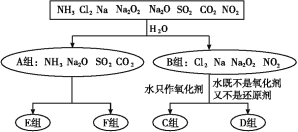
(1)上述分类中,分成A、B两组的依据是_________。
(2)D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有__(填化学式)。
(3)实验室由Al3+制备Al(OH)3时,应选择F组中_____(填化学式)的水溶液,离子方程式为______。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___,②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲组同学设计的实验装置如图所示,回答下列问题:
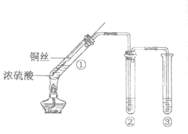
(1)试管①中反应的化学方程式是____________ 。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是____________。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
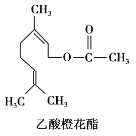
①属于芳香族化合物 ②不能发生银镜反应
③分子式为C12H20O2 ④它的同分异构体中可能有酚类
⑤1 mol该有机物水解时只能消耗1molNaOH
A. ②③④B. ②③⑤C. ①②③D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,回答问题。
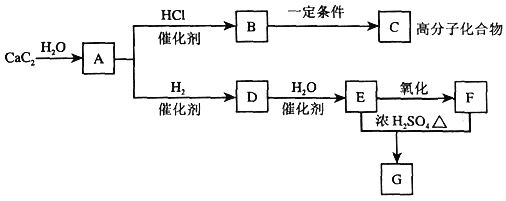
(1)B中所含官能团的名称是:_______。
(2)反应B→C的化学方程式是________;反应D→E的化学方程式是_______。
(3)B→C的反应类型属于______。
(4)写出实验室制取A的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。

(1)实验前检查装置气密性的方法为______________。
(2)检验实验中生成气体的实验操作是 _____________。
(3)写出试管中发生的化学反应方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解是一种非常强有力的促进氧化还原反应的手段,许多很难进行的氧化还原反应,都可以通过电解来实现。
(1)工业上常以石墨做电极,电解NaCl水溶液时,阴极区产物有____,其溶液可用于吸收工业尾气中的SO2,写出反应的化学方程式_____。
(2)电解NaCl水溶液时,用盐酸控制阳极区溶液的pH在2~3,用平衡移动原理解释盐酸的作用_____。离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上发生电镀,有铝产生。
(3)铝原子的核外电子排布式是____,其中有____种不同能级的电子。
(4)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当所得还原产物为6g时,转移电子的物质的量为___mol。
(5)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____(填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,不能说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com