
【题目】有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO![]() 、NO
、NO![]() 、Cl-五种离子,同时生成一种白色沉淀。
、Cl-五种离子,同时生成一种白色沉淀。
请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是 。
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C 。
(3)若将A、B、C三种正盐按一定比例溶于水后,所得溶液中只含有Fe3+、SO![]() 、NO
、NO![]() 、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种正盐的物质的量之比为 。
、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种正盐的物质的量之比为 。
【答案】
(1)D(2)FeCl3 AgNO3 K2SO4(3)1∶3∶2
【解析】
试题分析:等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为AgCl,则A为FeCl3,B为AgNO3,C为K2SO4,(1)由上述分析可知,正盐中含Ag+,三种阴离子与A、B、C中的阳离子均不会生成沉淀,故答案为:D;(2)由上述分析可知,A为FeCl3,B为AgNO3,C为K2SO4,故答案为:FeCl3;AgNO3;K2SO4;(3)Fe3+、SO42-、NO3-、K+四种离子且物质的量之比依次为1:2:3:4,设FeCl3为1mol,则AgNO3为3mol,K2SO4为2mol,A、B、C三种正盐的物质的量之比为1:3:2,故答案为:1:3:2。


科目:高中化学 来源: 题型:
【题目】下列化学反应中元素之间没有电子转移的是( )
A.HNO3和NH3反应生成NH4NO3
B.Fe在Cl2中点燃生成FeCl3
C.电解H2O制备H2和O2
D.H2和O2在燃料电池中转变H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B. 钠与水的反应 :![]()
C. 氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O
D. 氯气与水的反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的CO2和H2O而失效,漂白粉失效过程的化学反应方程式为:______。
(2)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。

①c过程的反应的离子方程式______,e过程中的离子方程式为 _______。
②d过程所观察到的现象为:____,原因: ____,b过程的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用高浓度含砷废水(主要成分为H3AsO3)制取As2O3的工艺流程如下图所示。
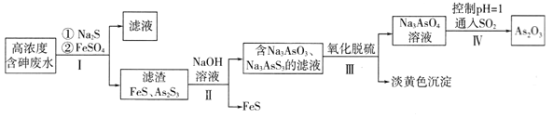
已知:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)
2AsS33-(aq)
(1)H3AsO3中As元素的化合价为______;H3AsO3的第一步电离方程式为:________。
(2)步骤I加入FeSO4的作用是______________________。
(3)步骤Ⅱ发生反应的化学方程式为___________________。步骤III“氧化脱硫”过程中被氧化的元素是___________(填元素符号)。
(4)步骤IV发生反应的离子方程式为________________________。
(5)利用反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
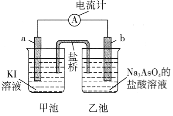
①起始时,b电极的电极反应式为__________________。
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是______________________________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=-752kJ·mol-1的反应机理如下:
N2(g)+2H2O(g) △H=-752kJ·mol-1的反应机理如下:
①2NO(g)![]() N2O2(g) (快)
N2O2(g) (快)
②N2O2(g)+H2(g)![]() N2O(g)+H2O(g) (慢)
N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g)![]() N2(g)+H2O(g) (快)
N2(g)+H2O(g) (快)
下列有关说法错误的是
A. ①的逆反应速率大于②的正反应速率
B. ②中N2O2与H2的碰撞仅部分有效
C. N2O2和N2O是该反应的催化剂
D. 总反应中逆反应的活化能比正反应的活化能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同,晶体类型不同的是
A.NaCl、HClB.CO2、SiO2 .C.SO2、H2OD.NH4Cl 、CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com