
(15分)甲醇是主要的化学工业基础原料和清洁液体燃料。工业上可以用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应及平衡常数 | 温度/℃ | ||
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||

(1)反应②的反应热△H2 0(填“>”、“<”或“=”);
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示。则平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”);
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________(用K1、K2表示)。500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v(正)______v(逆) (填“>”、“<”或“=”);
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________________________________;
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中乙酸的电离常数为_________________________。
(共15分)⑴ > (2分)⑵ =(2分)(3)K1·K2, > (各2分)
(4) 使用催化剂,将容器的体积迅速压缩至2L(各2分)(5) 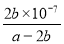 (3分)
(3分)
【解析】
试题分析:⑴由于反应②,升高温度,化学平衡常数增大,说明升高温度,平衡向正反应方向移动。根据平衡移动原理可知:正反应方向是吸热反应,所以△H2>0;(2)由于化学平衡常数只与温度有关,而与外界的压强、浓度等无关,如图显示的是反应①中H2的平衡转化率(a)与体系总压强(P)的关系由于温度不变,所以平衡状态由A变到B时,平衡常数K(A)= K(B);(3)根据反应的方程式可得化学平衡常数的表达式:K1= ;K2=
;K2= ;K3=
;K3= 可推导出K1、K2与K3之间的关系,则K3= K1·K2;500℃时测得反应③的化学平衡常数K3=2.5×1.0=2.5,在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Qc=
可推导出K1、K2与K3之间的关系,则K3= K1·K2;500℃时测得反应③的化学平衡常数K3=2.5×1.0=2.5,在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Qc=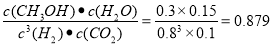 <2.5,说明反应还没有达到平衡状态,反应正向进行,此时v(正) >v(逆) ;(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,由于反应速率加快,但是CO的平衡含量没有变化,及平衡未发生移动则改变的条件是加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO浓度由原来的2mol/L 突然增大到3mol/L,CO的平衡浓度有原来的3mol/L变为4.5mol/L,都是原来曲线Ⅰ的1.5倍,则改变的条件是将容器的体积迅速压缩至2L ;(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),则电离的醋酸的浓度是2bmol/L,醋酸的总浓度是amol/L,所以用含a和b的代数式表示该混合溶液中乙酸的电离常数为K=
<2.5,说明反应还没有达到平衡状态,反应正向进行,此时v(正) >v(逆) ;(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,由于反应速率加快,但是CO的平衡含量没有变化,及平衡未发生移动则改变的条件是加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO浓度由原来的2mol/L 突然增大到3mol/L,CO的平衡浓度有原来的3mol/L变为4.5mol/L,都是原来曲线Ⅰ的1.5倍,则改变的条件是将容器的体积迅速压缩至2L ;(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),则电离的醋酸的浓度是2bmol/L,醋酸的总浓度是amol/L,所以用含a和b的代数式表示该混合溶液中乙酸的电离常数为K= .
.
考点:考查化学平衡常数的计算、应用、化学反应进行的方向的判断、影响化学平衡的因素、物质的电离平衡常数的表达式的计算的知识。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是

A.用甲图装置验证CH3COOH、H2CO3和H2SiO3的酸性强弱
B.用乙图装置配制一定浓度的稀硫酸
C.用丙图装置验证NaHCO3和Na2CO3的热稳定性
D.用丁图装置制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高三元月调考理综化学试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象,得出的结论正确的是
操作 | 现象 | 结论 | |
A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g) |
C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 上层分别呈无色和紫红色 | 还原性:I->Br- >Fe2+ |
D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 SO32- |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:选择题
25℃时,下列溶液中,离子浓度关系正确的是
A.pH=a的氨水稀释10倍后,其pH=b,则a=b+1
B.浓度相同的①NH4Cl ②CH3COONH4 ③NH4HSO4,三种溶液中的c(NH4+):①>③>②
C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c (NH4+)> c (Cl-) > c (H+) > c (OH-)
D.将a mol·L-1CH3COOH与b mol·L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。对下列现象或事实解释不正确的是
选项 | 现象或事实 | 解释 |
A | 用活性炭去除冰箱中的异味 | 活性炭具有吸附性 |
B | 漂白粉在空气中久置变质 | 漂白粉中的Ca(ClO)2 与空气中的 CO2及H2O反应生成CaCO3和HClO,HClO易分解 |
C | FeCl3溶液可用于制作铜质印刷线路板 | FeCl3溶液能将铜氧化为Cu2+ |
D | 用热碱水清除炊具上残留的油污 | Na2CO3可和油污直接发生反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省七校联盟高三第一次联考理综化学试卷(解析版) 题型:选择题
根据下图所给信息,得出的结论正确的是

A.48g碳完全燃烧放出热量为1574 kJ/mol
B.2C(s)+O2(g) 2CO(g) △H=-221.0kJ/mol
2CO(g) △H=-221.0kJ/mol
C.2CO2(g) 2CO(g)+O2(g) △H=+283.0kJ/mol
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g) CO2(s) △H=-393.5kJ/mol
CO2(s) △H=-393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(9分)有一同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。请回答有关问题。
(1)少量SO2通入到Ba(OH)2 溶液中的离子反应方程式为 。
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为 。
(2)该同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉 淀的成分,他设计了如下实验流程:

则操作①的名称为 ,试剂A的化学式为 。
(3)实验证明,加入试剂A后,白色沉淀未见溶解,试推测产生该白色沉淀的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质必须保存在棕色试剂瓶中的是
①氯水 ②氨水 ③浓硝酸 ④氢氧化钠 ⑤溴水
A、全部 B、①③⑤ C、①②③ D、①②④
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高一上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.氯气与氯化亚铁溶液反应:2FeCl2+CI2=2FeCl3
C.氯化铁溶液与铁反应:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++30H—=Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com