
| ʵ����� | ����ͽ��� |
| ����һ�� | ����������ɫ�������� �� |
| ������� | �����Ѳ�ʺ�ɫ���� �� |
| ʵ����� | ����ͽ��� |
| ����һ��ȡ��ȡ��õ����ϲ���Һ������2��K4[Fe(CN)6](�����軯��)��Һ��2�֣� | ����������ɫ�����������һ��������1�֣� |
| �������ȡ̽������������Һ�������������ѣ���������÷ֲ㣨2�֣� | �����Ѳ�ʺ�ɫ��������������1�֣� |


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 PCl5(g)�й��������£������жϲ���ȷ����
PCl5(g)�й��������£������жϲ���ȷ����| | PCl3(g) | Cl2(g) | PCl5(g) |
| ��ʼŨ��(mol/L) | 2.0 | 1.0 | 0 |
| ƽ��Ũ��(mol/L) | c1 | c2 | 0.4 |
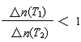
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3��g�� ��H=��92.4 kJ/mol
2NH3��g�� ��H=��92.4 kJ/mol| A��NH3���ɵ�������NH3�ֽ��������� |
B���������ķ�Ӧ���� v����NH3��=v����H2�� v����NH3��=v����H2�� |
| C�������ڵ��ܶȲ��ٱ仯 |
| D����λʱ��������a mol N2��ͬʱ����2a mol NH3 |
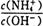 ֵ��_____(����� ����С�� ���䡱)��
ֵ��_____(����� ����С�� ���䡱)���鿴�𰸺ͽ���>>
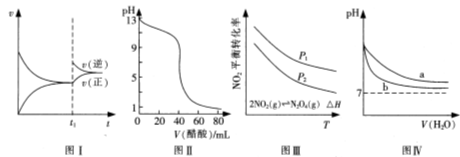
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)���й�����ͼ��˵���IJ���ȷ����
2C(g)���й�����ͼ��˵���IJ���ȷ����
| A������ͼa���ж�����ӦΪ���ȷ�Ӧ |
| B����ͼb�У����߿ɱ�ʾʹ���˴��� |
| C��������Ӧ�ġ�H��0��ͼc�ɱ�ʾ�����¶�ʹƽ�����淴Ӧ�����ƶ� |
| D����ͼd�л�������ƽ����Է����������¶ȵı仯���������֪����Ӧ�ġ�H>0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��ͼI�ɱ�ʾN2+3H2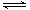 2NH3������ʱ��ͼ��t1ʱ�̸ı�������������¶� 2NH3������ʱ��ͼ��t1ʱ�̸ı�������������¶� |
| B��ͼ��ɱ�ʾ��0.1 000 mol/L����ζ�40.00 mL0.1000 mol/LNaOH��Һ�õ��ĵζ����� |
| C��ͼ��ɱ�ʾNO2ƽ��ת�������¶ȡ�ѹǿ�ı仯��ϵ����ͼ��֪����H<0��P1<P2 |
| D��ͼ���ɱ�ʾpH��ͬ��NaOH��Һ�백ˮϡ���̵�pH�仯����������a��Ӧ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 NH3(g) + HI(g)
NH3(g) + HI(g) H2(g) + I2(g)
H2(g) + I2(g)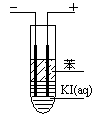
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2+CO2���������ڼ���1molCO��1mol H2O��g��ʱ������2/3mol CO2���ͨ���H2O��g����Ϊ4molʱ�������������£�����CO2�����ʵ���Ϊ
H2+CO2���������ڼ���1molCO��1mol H2O��g��ʱ������2/3mol CO2���ͨ���H2O��g����Ϊ4molʱ�������������£�����CO2�����ʵ���Ϊ| A��0��5mol | B��0��6mol | C��0��9mol | D��2��5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��
2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��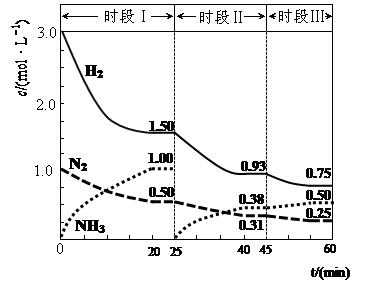
 5N2(g)+6H2O(g) ��H<0������Ӧ�ڣ�2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ��H<0������Ӧ�ڣ�2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g)��
2SO3(g)�� Fe3O4(g)��4H2(g)������м���SO2��O2��SO3�����ʵ����ֱ�Ϊx mol��3.25mol��1mol���Ҳ��м���9 mol��ˮ���������������ۣ��������۶����������Ӱ�죩��
Fe3O4(g)��4H2(g)������м���SO2��O2��SO3�����ʵ����ֱ�Ϊx mol��3.25mol��1mol���Ҳ��м���9 mol��ˮ���������������ۣ��������۶����������Ӱ�죩��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com