
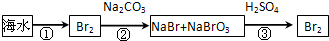
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区高一下学期期末考试化学试卷(解析版) 题型:实验题
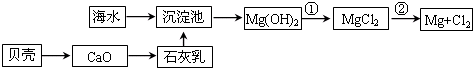
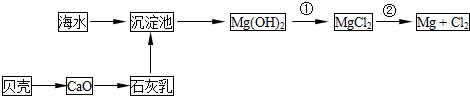
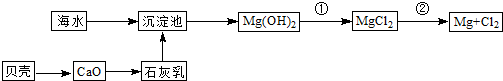
从海水提取镁和溴的流程如下,请回答相关问题。
(1)从海水中提取镁的流程如下图所示(框图中是主要产物):
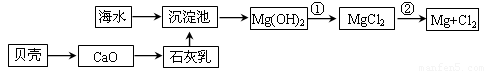
i.海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案________更合理,理由是_________________________________________。
ii.反应①的离子方程是________________________________________________。
反应②的化学方程式是_______________________________________________。
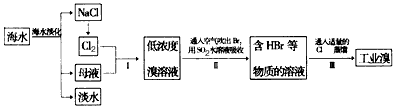
(2)从海水中提取溴的流程如下图所示(框图中是主要产物):


i.过程①中,加入的试剂是___________。
ii.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______________________________________________________________________。
iii.过程③中反应的化学方程式是____________________________________________。
iv.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是__________________________________________________(结合离子方程式回答)。
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com