
从海水提取镁和溴的流程如下,请回答相关问题。
(1)从海水中提取镁的流程如下图所示(框图中是主要产物):
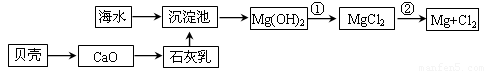
i.海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案________更合理,理由是_________________________________________。
ii.反应①的离子方程是________________________________________________。
反应②的化学方程式是_______________________________________________。
(2)从海水中提取溴的流程如下图所示(框图中是主要产物):


i.过程①中,加入的试剂是___________。
ii.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______________________________________________________________________。
iii.过程③中反应的化学方程式是____________________________________________。
iv.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是__________________________________________________(结合离子方程式回答)。
(9分)(1)i. 一 要加热海水需大量的能源,浪费了能源
ii. Mg(OH)2+2H+=Mg2++2H2O
; MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(2)i. Cl2
ii.温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出
iii.5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O(2分)
iv.加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-=Br2+2Cl-
【解析】
试题分析:(1)i.由于蒸发浓缩海水需要加热海水,从而消耗大量的能源,浪费了能源,所以方案一最好。
ii.氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中,反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O;镁是活泼的金属,需要电解法冶炼,电解熔融的氯化镁即可生成金属镁和氯气,反应的化学方程式是MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
(2)i.海水中的溴是以溴离子的形成存在的,需要加入氧化剂将其氧化生成单质溴,因此过程①中,加入的试剂是Cl2。
ii.由于温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出,因此要吹入热空气。
iii.在酸性条件下,溴酸钠能和溴化钠发生氧化还原反应生成单质溴,反应的化学方程式是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O。
iv. 氯气具有强氧化性,所以要出去单质溴中的少量氯气,可以加入适量溴化钠,利用有机溶剂将溴分离提纯,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。
考点:考查海水中金属镁和溴的提取、实验方案评价和方程式的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以海水的综合应用为载体,有利于调动学生的学习兴趣,激发学生的学习求知欲。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
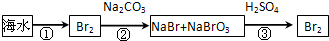
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com