
【题目】姜黄素有抗氧化、保肝护肝、抑制肿瘤生长等功能。它的结构简式如图所示

已知:
下列有关姜黄素的说法正确的是
A. 姜黄素在一定条件下能发生水解、加成、氧化反应
B. 1个姜黄素分子一定有15个原子共平面
C. 1mol姜黄素在镍(Ni)、加热条件下最多10molH2发生加成反应
D. 姜黄素的分子式为C21H18O6
【答案】C
【解析】姜黄素分子结构具有对称性,其中含有醚键、酚羟基、碳碳双键、羰基官能团,结合酚和烯烃的性质分析解答。
A. 姜黄素分子结构中没有能够水解的官能团,不能发生水解反应,故A错误;B.苯环、碳碳双键和羰基均为平面结构,但碳碳单键可以旋转,1个姜黄素分子中的碳原子可能都在同一平面上,但不一定有15个原子共平面,故B错误;C. 苯环、碳碳双键和羰基都能与氢气加成,1mol姜黄素在镍(Ni)、加热条件下最多10molH2发生加成反应,故C正确;D. 根据姜黄素的结构简式可知,姜黄素的分子式为C21H20O6,故D错误;故选C。
点晴:本题考查有机物的结构和性质,掌握官能团的结构和性质是解题的关键。本题的易错点为B,要根据常见的基本物质(甲烷、乙烯、乙炔、苯、甲醛)的结构分析解答,同时注意碳碳单键是可以旋转的,该分子中最少7个碳原子,最多21个碳原子共平面。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下述为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O ![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s) + O2 (g)=Cu2O(s) △H1= akJ/mol
②C(s)+ ![]()
![]() O2 (g)=CO(g) △H2= bkJ/mol
O2 (g)=CO(g) △H2= bkJ/mol
③Cu(s)+ ![]()
![]() O2 (g)= CuO(s) △H3= ckJ/mol
O2 (g)= CuO(s) △H3= ckJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O装置如图所示:

①如图装置中D电极应连______电极。(填“A”或“B”)
②该离子交换膜为______离子交换膜(填“阴”或“阳”),该电解池的B极反应式为:____________________________________________。
③C极反应式为:____________________________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O![]() 2H2(g)+O2(g)△H>0,水蒸气的浓度随时间t变化如表所示:
2H2(g)+O2(g)△H>0,水蒸气的浓度随时间t变化如表所示:

根据上述数据分析:
①催化剂的效率:实验①_______实验②(填“>”或“<”);
②通过实验①、③分析,T1______T2(填“>”或“<”);
③实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
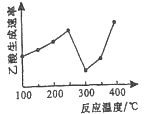
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
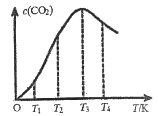
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于新型有机高分子材料的说法中,不正确的是( )
A.高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿造业等
B.复合材料一般是以一种材料作为基体,另一种材料作为增强剂
C.导电塑料是应用于电子工业的一种新型有机高分子材料
D.合成高分子材料制成的人工器官都受到人体的排斥作用,难以达到生物相容的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )
A. 脱落酸B. 生长素C. 乙烯D. 甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 _______、________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____(填“能”或“否”),其原因是 ______________________。
(3)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1· kg-1,各物质的密度均为1g·cm-3。
①计算完成上表数据计算结果。(保留小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:___________________________________ 。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,会使测定结果△H_____(填“偏大”、 “偏小” 或“无”)影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com