
【题目】(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
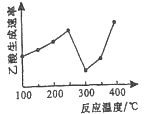
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
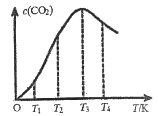
(3)一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
【答案】 728 kJmol-1 催化剂活性降低(或催化剂中毒等) 升高温度或增大压强等 BC 放热 40% 0.02a mol·min-1
【解析】(1)已知:①![]() 130KJ/mol,②2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。根据盖斯定律,将②
130KJ/mol,②2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。根据盖斯定律,将②![]() 3/2-①得:
3/2-①得:![]() ,即△H=(-572 kJ·mol -1
,即△H=(-572 kJ·mol -1![]() 3/2)-( -130kJ·mol-1)
3/2)-( -130kJ·mol-1)
=728 kJmol-1故![]() 的燃烧热为728 kJmol-1
的燃烧热为728 kJmol-1
(2)①催化剂的活性与温度有关,当温度在![]() 范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低。答案:催化剂活性降低(或催化剂中毒等)
范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低。答案:催化剂活性降低(或催化剂中毒等)
②欲使乙酸的平衡产率提高,应该使平衡正向移动。因为正反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高; 增大压强,平衡正向移动,乙酸的平衡产率提高;答案:升高温度或增大压强等
(3)①由2CO(g)![]() C(s)+CO2(g)。是两边气体体积数不等的反应,根据质量守恒定律
C(s)+CO2(g)。是两边气体体积数不等的反应,根据质量守恒定律
A.容器内混合物的质量不变不能作为判断平衡的依据,故A错;B.CO和CO2的物质的量之比不再变化说明CO和CO2的量不在改变,能作为判断平衡的标志;C.混合气体的平均摩尔质量是物质的质量比上物质的摩尔质量,根据方程式混合气体的平均摩尔质量不再变化,可以作为判断平衡的依据; 故C对;D. 根据2CO(g)![]() C(s)+CO2(g)CO CO2分别在等号的两侧,形成amolC=O键的同时形成2amolC
C(s)+CO2(g)CO CO2分别在等号的两侧,形成amolC=O键的同时形成2amolC![]() O键,所以D错;答案为B C。
O键,所以D错;答案为B C。
②向某恒容容器中通入一定量的CO发生上述反应,2CO(g)![]() C(s)+CO2(g),平衡后升高温度,CO2量逐渐减少,说明该反应是放热反应。答案;放热。
C(s)+CO2(g),平衡后升高温度,CO2量逐渐减少,说明该反应是放热反应。答案;放热。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
2CO(g)![]() C(s)+CO2
C(s)+CO2
初始物质的量 a 0 0
变化的物质的量 2x x x
平衡物质的量 a-2x x x
达平衡,CO的体积分数为75%,所以![]() =75% x=0.2a CO的平衡转化率=2
=75% x=0.2a CO的平衡转化率=2![]() 0.2a/a
0.2a/a![]() = 40%。0-10min内平均反应速率v(CO2)=0.2amol/10min = 0.02a mol·min-1.答案:
= 40%。0-10min内平均反应速率v(CO2)=0.2amol/10min = 0.02a mol·min-1.答案:
. 40% 0.02a mol·min-1。


科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g)![]() 2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
A.①②③⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油中裂解获得A是目前工业上生产A的主要途径,图中的N是高分子化合物。以A和1,3一丁二烯为原料合成N的流程如下:
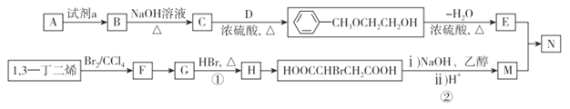
请回答下列问题:
(1)D物质的名称为_____;B→C的化学反应方程式为_____________。
(2)G中官能团的名称为_____________,由C→E涉及到的反应类型为_________。
(3)在催化剂存在下,E和M等物质的量发生聚合反应,N的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素有抗氧化、保肝护肝、抑制肿瘤生长等功能。它的结构简式如图所示

已知:
下列有关姜黄素的说法正确的是
A. 姜黄素在一定条件下能发生水解、加成、氧化反应
B. 1个姜黄素分子一定有15个原子共平面
C. 1mol姜黄素在镍(Ni)、加热条件下最多10molH2发生加成反应
D. 姜黄素的分子式为C21H18O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数.下列说法中正确的是( )
A. Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
B. 1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA
C. 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
D. S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH4+和[Cu(NH3)4]2+中都存在配位键
B.  σ键和π键比例为7:1
σ键和π键比例为7:1
C. ![]() 与
与![]() 互为等电子体,1 mol
互为等电子体,1 mol ![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
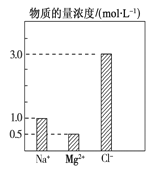
A. NaCl的物质的量为0.1mol
B. 该混合液中BaCl2的物质的量为0.05mol
C. 溶质MgCl2的质量为9.5 g
D. 将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A. 0.1molB. 0.2molC. 0.3molD. 0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com