
 (1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式| 1 |
| 2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol.L-1)-2 | 4.1X106 | K1 | K2 | … |
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
D、由CH2═CH-COOCH3合成的聚合物为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、② | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| 生成CO2的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
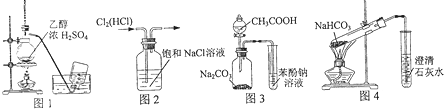
| A、利用图1装置制备乙烯 |
| B、利用图2装置除去Cl2中的HCl |
| C、利用图3装置证明酸性:CH3COOH>H2CO3>苯酚 |
| D、利用图4装置探究NaHCO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com