
【题目】Ⅰ.某化学兴趣小组在实验室用如下装置制备氯气:

请回答:
(1)实验装置连接完成后,首先应进行的操作是_______________。
(2)写出A装置中制取氯气的化学方程式____________________。
(3)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是____(填写数字编号)。
Ⅱ.某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了方案对废液进行以下三步处理,并回收金属。

请回答:
(1)步骤①中得到的沉淀含有的金属单质有__________。
(2)步骤②是将Fe2+转化为Fe3+,还可以选用的试剂是_____(填字母)。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步骤③中加入氨水生成红褐色沉淀的离子方程式为___________________。
【答案】检查装置的气密性 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O ③④②① Ag、Cu、Fe C Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
MnCl2+Cl2↑+2H2O ③④②① Ag、Cu、Fe C Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
【解析】
I.实验室用浓盐酸与二氧化锰加热制取氯气,生成的氯气中含有水蒸气和氯化氢,结合氯气的性质分析解答;
II.废液中含有Fe3+、Cu2+、Ag+三种金属离子,加入过量的铁粉后,银离子变成单质银、铜离子被还原成单质铜,铁离子被还原为亚铁离子;滤液中含有亚铁离子,加入双氧水,亚铁离子被氧化生成铁离子,再加入碱液,生成氢氧化铁沉淀,据此分析解答。
I.(1)制备气体的装置连接完成后,首先需要检查装置的气密性,故答案为:检查装置的气密性;
(2)A装置中二氧化锰与浓盐酸反应生成氯化锰、水、氯气,反应的化学方程式为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)制备的氯气中含水蒸气、氯化氢杂质气体,制备纯净、干燥的氯气需要通过饱和食盐水除去氯化氢,再通过浓硫酸除去水蒸气,导气管都应该长进短出,在A、B之间添加净化装置D、E,其中导管连接的顺序是③④②①,故答案为:③④②①;
II.(1)废液中含有Fe3+、Cu2+、Ag+三种金属离子,加入过量的铁粉后,银离子变成单质银、铜离子被还原成单质铜,铁离子被还原为亚铁离子,所以在操作①得到的沉淀中含有金属铜、银和过量的铁,故答案为:银、铜、铁;
(2)步骤②是将Fe2+转化为Fe3+,发生氧化反应,所以应加入氧化剂,除了双氧水外,还可以是新制氯水,故选C;
(3)氯化铁溶液中加入氨水生成氢氧化铁,反应的离子方程式为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。现在将有机物A 0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。则:
(1)此有机物的化学式为:_______________________________.
(2)已知此有机物含有苯环,在PMR谱上峰给出的稳定强度出现了五组峰,如图所示。请据图写出此有机物A的结构简式:__________________________.
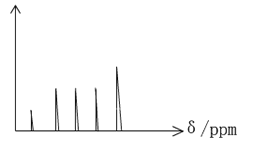
(3)请写出此有机物A在Ni的催化作用下与H2加成反应的化学方程式:________________.
(4)请写出此有机物A在浓H2SO4催化作用下与浓HNO3发生间位取代反应的化学方程式:_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如图:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是______________________。
(2)滤渣的主要成分为TiO2xH2O,写出TiOSO4水解生成TiO2xH2O的化学方程式为_____。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为______________。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因____________________________。
(5)步骤④的离子方程式为___________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法中正确的是( )
A.自然界中不存在游离态的硫
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
C.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
D.浓硫酸可用来干燥H2S、CO、Cl2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒之间,属于同位素的是(填字母),属于同素异形体的是 , 属于同一种物质的是 . A.红磷和白磷 B.氕和氚 C.氯气和液氯 D.冰和干冰 E.氧气和臭氧 H.13C和14C.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:①氯化铵 ②氦气 ③氯化镁 ④二氧化碳 ⑤过氧化氢 ⑥氯化钠 ⑦过氧化钠 其中:a.只含离子键的物质是(填编号,下同)
b.只含共价键的物质是
c.既有离子键又共价键的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)Y在周期表中位于________________;
(2)与钡同族的镁钙锶的碳酸盐受热分解的温度从上至下逐渐_______填“升高”或“降低”),原因是______________________________。
(3)①制备M的化学方程式是__________________________________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____________________m。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置制备乙烯的方案正确且检验乙烯时不需要除杂装置X的是![]()

乙烯的制备 | 试剂X | 试剂Y | |
A |
| 水 |
|
B |
| NaOH溶液 |
|
C |
| NaOH溶液 |
|
D |
| 水 |
|
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com