
【题目】下列关于硫及其化合物的说法中正确的是( )
A.自然界中不存在游离态的硫
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
C.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
D.浓硫酸可用来干燥H2S、CO、Cl2等气体
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是 ( )
A. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA
B. 1 mol甲基(—CH3)所含的电子总数为9NA
C. 0.5mol 1,3-丁二烯分子中含有C=C双键数为 NA
D. 1 mol Cl- 所含的电子数为18NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述中正确的是
A. 向0.1mol/LFeCl2溶液中通入足量Cl2,所得Fe3+数目小于0.1NA
B. 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电于数为0.2NA
C. 标准状况下,将3.36LCl2通入1L0.2mol/LFeBr2溶液中被氧化的Br-数目为0.1NA
D. 标准状况下,11g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )

A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及氮的化合物在生产生活中有着重要的用途,NH3、HNQ3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=_______m3,实际消耗了_____kg焦炭。
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
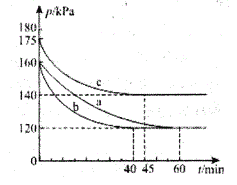
①与实验a相比,c组改变的实验条件可能是____________。
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为________。
(3)已知N2O4![]() 2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2![]() 2NO+O2 )。在1L的密闭容器中发生反应N2O4
2NO+O2 )。在1L的密闭容器中发生反应N2O4![]() 2NO2达到平衡状态。
2NO2达到平衡状态。
①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色____(和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色______,混合物中NO2的体积分数___________。
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2-]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组在实验室用如下装置制备氯气:

请回答:
(1)实验装置连接完成后,首先应进行的操作是_______________。
(2)写出A装置中制取氯气的化学方程式____________________。
(3)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是____(填写数字编号)。
Ⅱ.某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了方案对废液进行以下三步处理,并回收金属。

请回答:
(1)步骤①中得到的沉淀含有的金属单质有__________。
(2)步骤②是将Fe2+转化为Fe3+,还可以选用的试剂是_____(填字母)。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步骤③中加入氨水生成红褐色沉淀的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一物质结构与性质]
硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_____________;Se基态原子价电子排布图为___________。元素锌、硫和硒第一电离能较大的是______________________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为___________;H2SeO4的酸性比H2SeO3强,原因是_________________________________________________。
(3)气态SeO3分子的立体构型为__________;下列与SeO3互为等电子体的有____(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为_____(填元素符号);该晶胞中硒原子所处空隙类型为______________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为____________;若该晶胞密度为pg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_____nm。
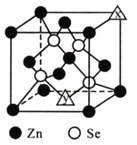
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com