
【题目】[化学一物质结构与性质]
硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_____________;Se基态原子价电子排布图为___________。元素锌、硫和硒第一电离能较大的是______________________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为___________;H2SeO4的酸性比H2SeO3强,原因是_________________________________________________。
(3)气态SeO3分子的立体构型为__________;下列与SeO3互为等电子体的有____(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为_____(填元素符号);该晶胞中硒原子所处空隙类型为______________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为____________;若该晶胞密度为pg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_____nm。
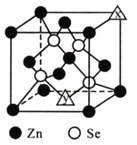
【答案】 第四周期IIB族 ![]() S sp3 H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se的化合价更高) 平面三角形 AB Zn 正四面体 50%
S sp3 H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se的化合价更高) 平面三角形 AB Zn 正四面体 50% 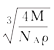 ×107
×107
【解析】(1) Zn的原子序数是30,其电子排布式为1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期ⅡB族;Se的原子核外有34个电子,最外层有6个电子,则其核外电子分4层排布,最外层为电子排布为4s24p4,基态原子价电子排布图为![]() ;锌金属性较强,第一电离能较小,S的非金属性强于As,第一电离能最大,即元素锌、硫和硒第一电离能较大的是S;(2)Na2SeO3分子中Se原子的价层电子对数为
;锌金属性较强,第一电离能较小,S的非金属性强于As,第一电离能最大,即元素锌、硫和硒第一电离能较大的是S;(2)Na2SeO3分子中Se原子的价层电子对数为![]() =4,所以Se杂化方式为sp3杂化;H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se的化合价更高),故H2SeO4的酸性比H2SeO3强;(3)SeO3的价层电子对数是3,Se原子上无孤电子对,故分子的立体构型是平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-等,答案选AB;(4)硒化锌的晶胞结构中原子个数比为1:1,其中Se原子4个,若X和Y点所堆积的原子均为Zn原子,则
=4,所以Se杂化方式为sp3杂化;H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se的化合价更高),故H2SeO4的酸性比H2SeO3强;(3)SeO3的价层电子对数是3,Se原子上无孤电子对,故分子的立体构型是平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-等,答案选AB;(4)硒化锌的晶胞结构中原子个数比为1:1,其中Se原子4个,若X和Y点所堆积的原子均为Zn原子,则![]() ,符合;则图中X和Y点所堆积的原子均为Zn原子;根据图中原子位置可知,该晶胞中硒原子所处空隙类型为正四面体,该种空隙的填充率为50%;若该晶胞密度为pg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏加德罗常数的数值,根据
,符合;则图中X和Y点所堆积的原子均为Zn原子;根据图中原子位置可知,该晶胞中硒原子所处空隙类型为正四面体,该种空隙的填充率为50%;若该晶胞密度为pg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏加德罗常数的数值,根据 ,所以V=
,所以V=![]() ,则晶胞的边长为
,则晶胞的边长为 cm=
cm= ×107 nm。
×107 nm。


科目:高中化学 来源: 题型:
【题目】朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾形成的种种美景的本质原因是
A. 光是一种胶体 B. 雾是一种胶体
C. 发生丁达尔效应 D. 空气中的小水滴颗粒直径大小约为1nm~100nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法中正确的是( )
A.自然界中不存在游离态的硫
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
C.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
D.浓硫酸可用来干燥H2S、CO、Cl2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:①氯化铵 ②氦气 ③氯化镁 ④二氧化碳 ⑤过氧化氢 ⑥氯化钠 ⑦过氧化钠 其中:a.只含离子键的物质是(填编号,下同)
b.只含共价键的物质是
c.既有离子键又共价键的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2===2Fe3++2Br-,2Br-+Cl2===Br2+2Cl- , 2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
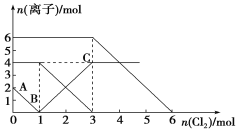
A. 还原性:I->Fe2+>Br-
B. 当通入2 molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C. 原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
D. 原混合溶液中FeBr2的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)Y在周期表中位于________________;
(2)与钡同族的镁钙锶的碳酸盐受热分解的温度从上至下逐渐_______填“升高”或“降低”),原因是______________________________。
(3)①制备M的化学方程式是__________________________________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____________________m。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4B.铜、二氧化硫
C.硫酸、乙醇D.熔融的KNO3、硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知3N2H4(l)![]() 4NH3(g)+N2(g) △H = —336.6kJ/mol,
4NH3(g)+N2(g) △H = —336.6kJ/mol,
N2(g)+3H2(g)![]() 2NH3(g) △H = —92.4kJ/mol,
2NH3(g) △H = —92.4kJ/mol,
则N2H4(g)![]() N2(g)+2H2(g) △H = ________________。
N2(g)+2H2(g) △H = ________________。
(2)写出下列物质的电离方程式:
①NaHSO4___________________________________,
②K2SO4_____________,
③NH4NO3___________________________。
(3)写出下列物质的电子式:
Na2S:_________;CO2:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将反应E+B2+=E2++B设计成原电池,下列4个电极反应: ①B﹣2e﹣=B2+
②E﹣2e﹣=E2+
③B2++2e﹣=B
④E2++2e﹣=E
其中表示负极反应和正极反应的分别是( )
A.②和③
B.②和①
C.③和①
D.④和①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com