
【题目】Ⅰ.某温度(t℃)时,水的Kw=10-13,则该温度(填 “大于”“小于”或“等于”)_________ 25℃,理由是_________,将此温度下pH =11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合液为中性,则a∶b_________;
(2)若所得混合液的pH=2,则a∶b_________。
Ⅱ.25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是(_____)
A.该溶液pH=4 B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7 D.升高温度,溶液的pH增大
【答案】 大于 水的电离吸热,升高温度,促进水的电离,KW 增大 10:1 9:2 D
【解析】Ⅰ.升高温度促进水的电离,则水的离子积常数增大,某温度(t°C)时水的Kw=1×10-13>1×10-14,则该温度大于25°C,故答案为:大于;升高温度促进水电离;
(1)pH=11的NaOH中c(OH-)=0.01mol/L,pH=1的硫酸中c(H+)=0.1mol/L,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),则0.01a =0.1b,a:b=10:1,故答案为:10:1;
(2)若所得混合液的pH=2,混合溶液中c(H+)=0.01mol/L,c(H+)=![]() =0.01mol/L,a:b=9:2,故答案为:9:2;
=0.01mol/L,a:b=9:2,故答案为:9:2;
Ⅱ.A.c(H+)=0.1molL-1×0.1%=10-4mol/L,pH=-lg10-4=4,故A正确;B.水电离出的c(H+)等于溶液中c(OH-)=![]() mol/L=10-10mol/L,由HA电离出的c(H+)为10-4mol/L,所以由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故B正确;C.电离平衡常数K=
mol/L=10-10mol/L,由HA电离出的c(H+)为10-4mol/L,所以由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故B正确;C.电离平衡常数K=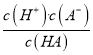 =
=![]() mol/=1×10-7molL-1,故C正确;D.HA的电离是吸热反应,升高温度促进HA电离,溶液中氢离子浓度增大,则溶液的pH减小,故D错误;故选D。
mol/=1×10-7molL-1,故C正确;D.HA的电离是吸热反应,升高温度促进HA电离,溶液中氢离子浓度增大,则溶液的pH减小,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】有着“植物大熊猫”和世界上最长寿树种美称、在地球上已有250万年历史的红豆杉,入选2010年世博会中国馆珍稀植物展出品种。其体内含量最多的化学元素和最基本的化学元素分别是
A. C和O B. C和H C. H和O D. O和C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图形不一致的是

A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液pH随加酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量0.1 mol·L-1草酸溶液混合,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g) →CH3CH3(g);ΔH>0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理的有关知识回答下列问题:
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2 △H=-989.2 kJ·mol-1,有关键能数据如下表:
化学键 | Si-O | O=O | Si-Si |
键能kJ·mol-1 | X | 498.8 | 176 |
则X的值为_________。
(2)加热N2O5,依次发生的分解反应为①N2O5![]() N2O3+O2,②N2O3
N2O3+O2,②N2O3![]() N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
(3)一只规格为amL的滴定管,其尖嘴部分充满溶液,管内液面在mmL处,当液面降到n mL处时,下列判断正确的是_________。
A.流出溶液的体积为(m-n)mL B.流出溶液的体积为(n-m)mL
C.管内溶液体积等于(a-n)mL D.管内溶液体积多于nmL
(4)已知某二元酸(H2A)溶液按下式发生一级和二级电离:H2A=H++HA-;HA-![]() H++A2-,且0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是_________0.11 mol·L-1(填“<”“>”或“=”),理由是__________。
H++A2-,且0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是_________0.11 mol·L-1(填“<”“>”或“=”),理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能证明HNO2是弱电解质的是
A. 用HNO2溶液做导电实验,灯泡很暗; B. 0.1mol/LHNO2溶液的pH=2.1
C. HNO2不是离子化物,而是共价化合物 D. HNO2和NaCl不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( ) 
A.该反应是吸热反应
B.断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C.断裂2molA﹣B键需要吸收ykJ能量
D.2molAB的总能量高于1molA2和1molB2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X,Y,Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X,Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O, 含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1) “酸浸”时盐酸与 CuCO3·Cu(OH)2 反应的化学方程式为 ________________。 为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③______________。
(2) “氧化”时发生反应的离子方程式为__________________。
(3) “滤渣 2”的主要成分为_______(填化学式);“调pH”时,pH 不能过高,其原因是___________。
(4) “加热脱水”时, 加入 SOCl2的目的是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com