

| A、由图可知,2molR的能量高于1molM和1molN的能量和 |
| B、曲线B代表使用了催化剂,反应速率加快,M的转化率:曲线B>曲线A |
| C、1molM和1molN的总键能高于2molR的总键能 |
| D、对反应2R(g)?M (g)+N (g)使用催化剂没有意义 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )
一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )| A、d是ClO3- |
| B、b→a+c反应的活化能为60kJ?mol-1 |
| C、a,b,c,d中c最稳定 |
| D、b→a+c反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA |
| B、10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
| C、高温下,0.2mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA |
| D、25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性条件下,用H2O2将I-转化为I2:H2O2+2I-═I2+2OH- |
| B、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、氨水溶解氯化银固体:AgCl+2 NH3?H2O═[Ag(NH3)2]++Cl-+2H2O |
| D、用饱和纯碱溶液洗涤试管中残留的苯酚:CO32-+2C6H5OH→2C6H5O-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
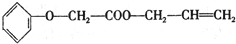 )的制备方法,据此回答问题:
)的制备方法,据此回答问题:
 (R-、R′-代表烃基)
(R-、R′-代表烃基) 的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3: | 有白色沉淀产生,说明样品中含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com