
【题目】下列反应的离子方程式中或电离方程式正确的是
A. 将硫酸氢钠溶液与碳酸氢钠溶液混合:CO32-+2H+=CO2↑+H2O
B. 向NaHSO4溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀:2H++SO42-+2OH-+Ba2+=2H2O+BaSO4↓
C. 氧化铜与稀硫酸反应:2H++O2-=H2O
D. HSO3-在水中的电离:HSO3- + H2O ![]() SO32-+ H3O+
SO32-+ H3O+
科目:高中化学 来源: 题型:
【题目】由U形管、铁棒、碳棒和CuCl2溶液组成如图所示装置,下列说法不正确的是
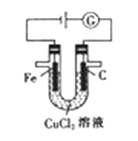
A. 铁棒为阴极,碳棒为阳极
B. 阴极的电极反应式为Cu2++2e-==Cu
C. 转移0.2mol电子时,阳极生成2.24L气体
D. 若将碳棒换成铜棒,可实现在铁棒上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)常用于制造医药品、染料等。通常情况下其熔点为-54.1℃,沸点69.2℃,遇水发生剧烈反应生成氯化氢气体。某实验小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯,其实验装置如下:

(1)有关冷凝管的使用原理,下列说法正确的是(填字母)______________。
a.蒸气冷凝在内管的外壁上
b.当蒸馏液体的沸点超过140℃,水冷易炸裂仪器,此时多采用空气冷凝管
c.蛇形冷凝管多用于有机制备的回流,适用于沸点较低的液体
d.内外管所围出的空间为行水区,有吸收蒸气热量并将热量移走的功用
(2)B中的试剂为___________,作用为______________________________。
(3)在不改变装置的前提下,丁中的KClO3可用_____________代替(填化学式)。
(4)该小组向Cu(NO3)2·3H2O晶体中滴加SO2C12制备少量无水Cu(NO3)2。
①请写出SO2C12与水反应的化学方程式__________________________________。
②滴加SO2C12的作用除了吸水之外,还有_____________________________。
(5)测定无水Cu(NO3)2的纯度,可用分光光度法。现测得[Cu(NH3)4]2+的吸光度A与Cu2+标准浓度关系如图所示(已知4NH3·H2O+Cu2+==[Cu(NH3)4]2++4H2O)。
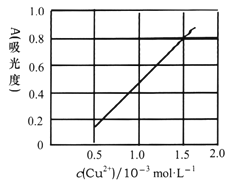
称取0.3150g制得的无水Cu(NO3)2样品,用蒸馏水溶解并配制成100mL溶液,用__________(填仪器名称)准确量取10.00mL,加过量氨水,再用蒸馏水稀释至100mL,测得其吸光度A=0.8。则此无水Cu(NO3)2样品的纯度是___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=-752kJ/mol的反应机理如下:
N2(g)+2H2O(g) △H=-752kJ/mol的反应机理如下:
①2NO(g)![]() N2O2(g)(快)
N2O2(g)(快)
②N2O2(g)+H2(g)![]() N2O(g)+H2O(g)(慢)
N2O(g)+H2O(g)(慢)
③N2O(g)+H2(g)![]() N2(g)+H2O(g)(快)下列有关说法正确的是
N2(g)+H2O(g)(快)下列有关说法正确的是
A. N2O2和N2O是该反应的催化剂 B. ②的反应的活化能最小
C. 反应速率v(NO)=v(H2)=v(N2) D. 总反应中逆反应的活化能比正反应的活化能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含铝锂钴废料[铝箔、CoO和Co2O3(只溶于酸,不溶于碱)及LiCoO2]中回收氧化钴的工艺流程如下:

回答下列问题:
(1)步骤I“碱溶”时,为提高铝的去除率,除升高温度和不断搅拌外,还可采取的措施是____(列举1点),“碱溶”时发生主要反应的化学方程式为_______;步骤II“过滤、洗涤”过程中滤渣还会有少量的Al(OH)3,是因为________(填离子方程式)。
(2)步骤III“酸溶”时,Co2O3 转化为CoSO4 的离子方程式为_________。
(3)步骤V“除铝和锂”时,调节pH的适用范围是_______(已知该条件下,Al3+开始沉淀时的pH为4.1,沉淀完全时的pH为4.7.Co2+开始沉淀时的pH为6.9。沉淀完全时的pH为9.4);步骤VI所得滤渣的成分为__________。
(4)煅烧CoC2O4时发生氧化还原反应,则CoC2O4分解的化学方程式是___;若仅从沉淀转化角度考虑,能否利用反应CoCO3+ C2O42-=== CoC2O4 + CO32- 将CoCO3 转化为CoC2O4?___ (填“能”或“不能”),说明理由:________[已知Ksp(CoCO3) =1.4×10-13,Ksp(CoC2O4)=6.3×10-8]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,c不易被腐蚀。则三种金属的活动性由强到弱的顺序为
A. a>b>c B. a>c>b C. c>b>a D. b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com