
| A. | 按系统命名法,化合物CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是2-甲基-3,4-二乙基戊烷 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
分析 A、烷烃的命名遵循长、多、近、小、简原则;
B、相对分子质量大于10000的属于高分子化合物;
C、甲醚与乙醇的分子式相同,属于同分异构体;
D、羟基乙酸中既含有羟基又含有羧基,据此解答即可.
解答 解:A、CH3CH(C2H5)CH(C2H5)CH(CH3)2的属于烷烃,最长碳链为6,在2和4号碳上各含有1个甲基,在3号碳上含有1个乙基,正确命名为:2,4-二甲基-3-乙基己烷,故A错误;
B、蔗糖为小分子化合物,不是高分子化合物,故B错误;
C、甲醚(CH3OCH3)与乙醇(CH3CH2OH)的分子式相同,均是C2H6O,属于同分异构体,故C错误;
D、羟基乙酸中既含有羟基又含有羧基,羟基与羧基能发生酯化反应(属于取代反应),羧基与羟基能发生缩聚反应生成高分子酯类化合物,故D正确,
故选D
点评 本题主要考查的是同分异构体的判断、高分子化合物的概念、常见官能团的性质,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
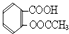 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

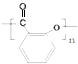 .
.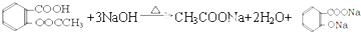 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
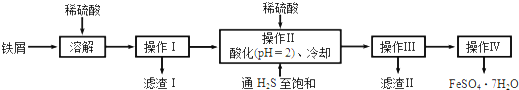
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
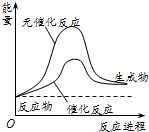
| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
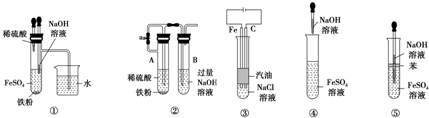
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
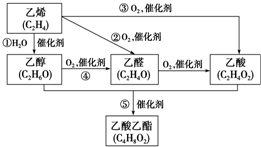 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线: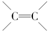 ,乙醇中含氧官能团的名称是羟基;
,乙醇中含氧官能团的名称是羟基;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5 mol HCl | B. | 2.5 mol H2O | ||
| C. | 108.5 g 33.6%的盐酸 | D. | 145 g 50.3%的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com