
(1)Na2O和Na2O2的混合物0.14 g与足量水反应,得到400 mL溶液,其中含溶质0.16 g 。试计算:?
①原混合物中Na2O2的质量。
②所得溶液的pH。
(2)取上述溶液 100 mL,通入标准状况下的CO2气体16.8 mL,所得溶液中各离子浓度由大到小的顺序为___________________。(此问不要求写计算过程)?
(1)解:①Na2O+H2O══2NaOH?
2Na2O2+2H2O══4NaOH+O2↑?
设Na2O、Na2O2的物质的量分别为x、y。?
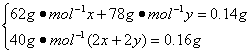 ?
?
![]()
m(Na2O2)=78 g·mol -1×0.001 mol=0.078 g?
②n(NaOH)=2(x+ y)mol=0.004 mol
c(NaOH)=![]() =0.01 mol·L -1pH=12?
=0.01 mol·L -1pH=12?
(2)c(Na +)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH -)>c(H +)
)>c(OH -)>c(H +)
解析:由题意知溶质应为NaOH,故n(NaOH)=![]() =0.004 mol,由题目知混合物0.14 g。生成n(NaOH)=0.004 mol,则可用二元一次方程组解决。所得溶液为NaOH溶液c(OH -)=
=0.004 mol,由题目知混合物0.14 g。生成n(NaOH)=0.004 mol,则可用二元一次方程组解决。所得溶液为NaOH溶液c(OH -)=![]() =0.01 mol·L -1,pH=12。?
=0.01 mol·L -1,pH=12。?
(3)通入CO2 ?n(CO2)=![]() =0.000 75 mol,取100 mL则n(NaOH)=0.001 mol。
=0.000 75 mol,取100 mL则n(NaOH)=0.001 mol。
由十字交叉
则n(Na2CO3):n(NaHCO3)=1∶2,推知n(Na2CO3)=0.00025 mol,n(NaHCO3)=0.000 5 mol,此溶液显碱性,则c(Na +)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH -)>c(H +)
)>c(OH -)>c(H +)


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:阅读理解
 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源:2013届贵州省遵义四中高三第二次月考理科综合化学试卷(带解析) 题型:实验题
(16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合: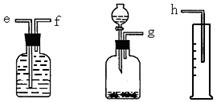
①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年贵州省高三第二次月考理科综合化学试卷(解析版) 题型:实验题
(16分)(1)(6分) 测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:

①用接口字母标出各仪器连接的顺序 量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是 。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+ D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com