
����Ŀ����1.0molL��1KI��Һ�м������I2 �� ������Ӧ��I2��aq��+I�� ��aq���TI3����aq����H��I�������ʵ���Ũ��c��I�������¶�T�ı仯������ͼ��ʾ����֪��Ӧ��һ�δﵽƽ��ʱ��ʱ10s��������˵����ȷ���ǣ� �� 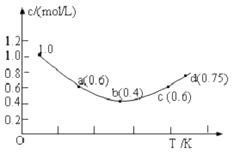
A.�÷�Ӧ�ġ�H��0
B.a��c�����Ӧ��I����Ӧ�������
C.b��ʱ0��10s I����ƽ����Ӧ����Ϊ0.04molL��1s��1
D.d��ʱ�÷�Ӧ�ڶ�Ӧ�¶��´���ƽ��״̬
���𰸡�D
���������⣺A��b������¶����ߣ���ƽ�������ƶ�����������Ӧ�Ƿ��ȷ�Ӧ�����H��0����A����
B���¶�Խ������Խ�죬c����¶ȸ���a���¶ȣ�����c������ʴ���a������ʣ���B����
C��b����ƽ��״̬��b��ʱ0��10s I����ƽ����Ӧ����Ϊv��I����= ![]() =0.060.04molL��1s��1 �� ��C����
=0.060.04molL��1s��1 �� ��C����
D��b���������ϵĵ㶼�Ƕ�Ӧ�¶��µ�ƽ��״̬������d���ڶ�Ӧ���¶��´���ƽ��״̬����D��ȷ��
��ѡD��
�����㾫�������û�ѧƽ��״̬���ʼ���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش�����������
��1������NaOH��Na2CO3��Ba(OH)2������ɫ��Һ��ѡ��һ���Լ������Ǽ����������д����Ӧ�����ӷ���ʽ��
�ټ����Լ�____________��
�ڷ�Ӧ�����ӷ���ʽ__________________��________________��________________��
��2��ij�����ķ�ˮ�к��д�����FeSO4���϶��Cu2+������Na+��Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л���FeSO4��Cu�����������ͼ���ڷ������������д���ʵ�����(����Ҫ�ɷֵĻ�ѧʽ)�������������ɻ���FeSO4��Cu�ļ�ʵ�鷽����_____________��_____________��_____________��_____________��_____________��_____________��_____________��
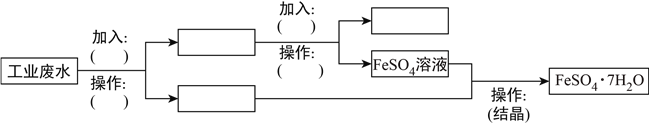
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǵ����ʴ�л�IJ��Ҳ����Ҫ�Ļ�ѧ���ϣ���ҵ�ϳ����ط�Ӧ���£�
2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��
��1����һ����պ����ܱ������г���CO2��NH3����������Ӧ�ϳ����أ��㶨�¶��»�������еİ���������ͼ1��ʾ�� 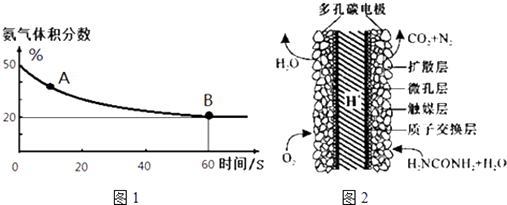
A�������Ӧ����v����CO2��B����淴Ӧ����v�棨CO2�������������������=������������ƽ��ת����Ϊ ��
��2������������Ǻϳ����ص�һ���м����������Ϊ2��1��NH3��CO2����������һ���ݻ����������ܱ������У��ں㶨�¶���ʹ�䷢�����з�Ӧ���ﵽƽ�⣺2NH3��g��+CO2��g���TNH2COONH4��s����ʵ���õIJ�ͬ�¶��µ�ƽ���������ڱ���
�¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ��������Ũ�� ��10��3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�ٹ���������Ӧ���ʱ䡢�ر�˵����ȷ���� ��
A����H��0����S��0B����H��0����S��0 C����H��0����S��0D����H��0����S��0
�ڹ���������Ӧ��ƽ��״̬����˵����ȷ����
A������������İ�������泥���Ӧ���ת���ʽ�����
B��ƽ��ʱ������ϵ�¶ȣ�CO2����������½�
C��NH3��ת����ʼ�յ���CO2��ת����
D��������Ч�Ĵ����ܹ���߰�������淋IJ���
�۰�������識���ˮ���̼��泥���������ˮ������ף�����������立�ĩ����1L0.1mol/L��������Һ��ֱ��pH=7�������£�������Һ����仯��������ȥ0.052mol��������泥���ʱ��Һ�м�������̼Ԫ�أ�
��ʱ��Һ��c��NH4+��=�����������ֵ��NH4+ˮ��ƽ�ⳣ��ֵΪ ��
��3����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��磡�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ���ܷ��磮����ȼ�ϵ�ؽṹ��ͼ2��ʾ��д���õ�صĸ�����Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ�С�H2����H1���ǣ� ��
A.2H2��g��+O2��g���T2H2O��g������H1��? 2H2��g��+O2��g���T2H2O��l������H2
B.S��s��+O2��g���TSO2��g������H1�� ?S��g��+O2��g���TSO2��g������H2
C.C��s��+ ![]() ?O2��g���TCO��g������H1��? C��s��+O2��g���TCO2��g������H2
?O2��g���TCO��g������H1��? C��s��+O2��g���TCO2��g������H2
D.H2��g��+Cl2��g���T2HCl��g������H1��? ![]() H2��g��+
H2��g��+ ![]() ?Cl2��g���THCl��g������H2
?Cl2��g���THCl��g������H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ��ɱ������Ч�ʸߡ�������ȾС��ˮ��������ʵ�����п�ͨ�����·�Ӧ�Ƶã�2KClO3��H2C2O4��H2SO4![]() 2ClO2����K2SO4��2CO2����2H2O������˵������ȷ������ ��
2ClO2����K2SO4��2CO2����2H2O������˵������ȷ������ ��
A��CO2����������
B��H2C2O4�ڷ�Ӧ�б�����
C��H2C2O4��������ǿ��ClO2��������
D��ClO2��ˮ������ʱ����������ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������д���¿հף�
��1�����������ʣ� ��NaHSO4���� ��SO3 ��Һ̬���� ���� ��BaSO4���� ������ FeCl3��Һ ��
�ƾ���C2H5OH�� �����ڵ� K2SO4�������ܵ������__________�����ڵ���ʵ���_________�����ڷǵ���ʵ���______________
��2�� ��ѧ��Ӧ FeS+ H2SO4��Ũ��![]() Fe2(SO4)3+ SO2��+ S��+ H2O��δ��ƽ���У�
Fe2(SO4)3+ SO2��+ S��+ H2O��δ��ƽ���У�
���������ǣ�_______�� ��ԭ�����ǣ�_______��
��3�� ��д������������������Һ��Ӧ�����ӷ���ʽ_______��
��4�� ������Գ����⣬ ��д��������Ӧ�����ӷ���ʽ_______��
��5�� ��ҵ�ϳ��� H2O2������������������ˮ�е� Fe2+����д�����ӷ���ʽ��_______��
��6��ijҺ̬������ X2Y4���������ȼ�ϡ� 32 g X2Y4��һ������ O2��ǡ����ȫȼ�գ���Ӧ����ʽΪ�� X2Y4(l)��O2(g) ![]() X2(g)��2Y2O(l)����ȴ���ڱ�״���²������������Ϊ 22.4 L�����ܶ�Ϊ 1.25 g��L��1�� X2��Ħ������Ϊ_____________�� X2Y4��ѧʽΪ________________����ע�� l��Һ̬�� g����̬��
X2(g)��2Y2O(l)����ȴ���ڱ�״���²������������Ϊ 22.4 L�����ܶ�Ϊ 1.25 g��L��1�� X2��Ħ������Ϊ_____________�� X2Y4��ѧʽΪ________________����ע�� l��Һ̬�� g����̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������һ���Լ�����ģ� ��
A.��ϩ����������
B.������ϩ�����Ȼ�̼
C.���顢��ϩ������
D.��Ȳ����ϩ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������У���ȷ���ǣ� ��
A.2��4����������
B.2��3��3����������
C.2���һ���1����ϩ
D.2��2��3��������1����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�����������Ҫ�������£�
a������һ��������ŨH2SO4��ŨHNO3�Ļ���ᣬ���뷴Ӧ���У�
b���������µĻ��������μ���һ�����ı����������Ͼ��ȣ�
c����55�桫60���·�����Ӧ��ֱ����Ӧ������
d����ȥ�����ֲ�Ʒ����������ˮ��5% NaOH��Һϴ�ӣ������������ˮϴ�ӣ�
e��������ˮCaCl2�����Ĵ��������������õ�������������
����д���пհף�
������һ��������ŨH2SO4��ŨHNO3�Ļ����ʱ��������ע�������ǣ� ��
�ڲ���d��ϴ�ӡ������������Ӧʹ�õ������� ��
�۲���d�дֲ�Ʒ��5% NaOH��Һϴ�ӵ�Ŀ���� ��
���Ʊ��������Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com