
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后的产物再溶于水可得Z溶液,Y和Z溶液反应又可生成X,则盐X是
A.NH4NO3 B.NH4Cl C.(NH4)2SO4 D.NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下:

Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入3 mL浓硫酸、12.2 g苯甲酸、20 mL甲醇(密度约为0.79 g/cm3)。
(1)液体混合时,正确的加入顺序是 。
(2)为防止圆底烧瓶中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)在该反应中反应物甲醇应过量,其理由是 。
Ⅱ.粗产品的精制
(4)现拟用下列流程精制苯甲酸甲酯,请根据流程图填入恰当操作方法的名称:操作1为 ,操作2为 。

(5)苯甲酸甲酯的产率为 。
(6)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,某同学做了如下检验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
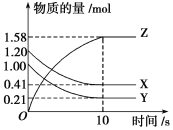
(1)从反应开始到10 s时,用Z表示的反应速率为_____________________________。
(2)该反应的化学方程式为__________________________________________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ____________。
2HI(g)达到平衡状态的是 ____________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_________。
C(g)+D(g)达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:


(1)电解时的阳极反应方程式为____________________________________。
(2)除去ClO2中的NH3可选用的试剂为是_____(填标号)
A.水 B.浓硫酸 C.碱石灰 D.饱和食盐水
(3)用右图装置可以测定混合气中ClO2的含量:
I.在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸;
II.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III.将一定量的混合气体通入锥形瓶中吸收;
IV.将玻璃液封装置中的水倒入锥形瓶中;
V.用0.2000mol/L 硫代酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32—===2I—+S4O62—),指示剂显示终点时共用去20.00ml硫代酸钠溶液。在此过程中:
①玻璃液封装置的作用是_________。
② V中加入的指示剂通常为______,滴定至终点的现象是______。
③测定混合气中ClO2的质量为______g。
④用此方法测定混合气中ClO2的质量常常偏高,可能的原因是_____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)请写出B、D、F三种元素的名称: 、 、 。
(2)A与C以原子个数比为1:1形成的化合物的电子式为 ,
将4mol该化合物投入到2L1mol/L BE3溶液中的离子方程式
为 、 。
(3)写出实验室制备F的氢化物的化学方程式 。
(4)下图可用于实验证明D、E的非金属性的强弱。

①溶液a和b分别为 , (写化学式)。
②非金属性D E(填大于或小于),请从原子结构的角度解释原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液显弱碱性,其原因为___________________(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,在0.10molL-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=_______ molL-1;
②某溶液含0.020molL-1Mn2+、0.10molL-1H2S,当溶液pH=_______时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]。
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________;
②0.10molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________;
③H2SO3溶液和NaHCO3溶液反应的离子方程式为___________________;
(4)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。久存的银器皿表面会变黑,失去银白色的光泽,原因是___________________,已知Ksp(AgCl)=1.8×10-10,若向5mL0.018molL-1的AgNO3溶液中加入5mL0.020molL-1的盐酸,混合后溶液中的Ag+的浓度为_______molL-1,pH为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com