
����Ŀ����.һ���¶��£���2 L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��
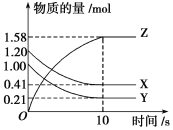
��1���ӷ�Ӧ��ʼ��10 sʱ����Z��ʾ�ķ�Ӧ����Ϊ_____________________________��
��2���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________________��
��.�ں��º��ݵ��ܱ������У����������������ٷ����仯ʱ���ٻ�������ѹǿ���ڻ��������ܶȣ��ۻ������������ʵ������ܻ�������ƽ����Է����������ݻ���������ɫ������Ӧ���������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮��
��1��һ����֤��2SO2(g)��O2(g)![]() 2SO3(g)�ﵽƽ��״̬����_______������ţ���ͬ����
2SO3(g)�ﵽƽ��״̬����_______������ţ���ͬ����
��2��һ����֤��I2(g)��H2(g)![]() 2HI(g)�ﵽƽ��״̬���� ____________��
2HI(g)�ﵽƽ��״̬���� ____________��
��3��һ����֤��A(s)��2B(g)![]() C(g)��D(g)�ﵽƽ��״̬����_________��
C(g)��D(g)�ﵽƽ��״̬����_________��
���𰸡���.��1��0.079 mol��L��1��s��1 ��2��X(g)��Y(g)![]() 2Z(g) ��.��1���٢ۢ� ��2���� ��3���ڢ�
2Z(g) ��.��1���٢ۢ� ��2���� ��3���ڢ�
��������
�����������.��1���ӷ�Ӧ��ʼ��10 sʱ��Z�����ʵ���������1.58mol��Ũ����1.58mol��2L��0.79mol/L������Z��ʾ�ķ�Ӧ����Ϊ0.79mol/L��10s��0.079mol/(L��s)��
��2������ͼ���֪X��Y�����ʵ�����С���Ƿ�Ӧ�ƽ��ʱ�仯���ֱ���1.20mol��0.41mol��0.79mol��1.00mol��0.21mol��0.79mol��Z�����ʵ���������1.58mol��Z����������ݱ仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪�÷�Ӧ�Ļ�ѧ����ʽΪX(g)��Y(g)![]() 2Z(g)��
2Z(g)��
�������������ܶ��ǻ������������������ݻ��ı�ֵ����������ƽ����Է��������ǻ��������������ܵ����ʵ����ı�ֵ����ɫ����dz����ɫ�����Ũ���й�ϵ�����κ�ʱ������Ӧ���������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮������
��1����Ӧ2SO2(g)��O2(g)![]() 2SO3(g)�������С�Ŀ��淴Ӧ����˻�������ѹǿ���������������ʵ�������������ƽ����Է����������������˵���ﵽƽ��״̬��
2SO3(g)�������С�Ŀ��淴Ӧ����˻�������ѹǿ���������������ʵ�������������ƽ����Է����������������˵���ﵽƽ��״̬��
��2����ӦI2(g)��H2(g)![]() 2HI(g)���������Ŀ��淴Ӧ�����ڵ�����ɫ���壬������������ɫ����˵���ﵽƽ��״̬��
2HI(g)���������Ŀ��淴Ӧ�����ڵ�����ɫ���壬������������ɫ����˵���ﵽƽ��״̬��
��3����ӦA(s)��2B(g)![]() C(g)��D(g)���������ģ���������������ӵĿ��淴Ӧ��������������ܶ�����������ƽ����Է���������������˵���ﵽƽ��״̬��
C(g)��D(g)���������ģ���������������ӵĿ��淴Ӧ��������������ܶ�����������ƽ����Է���������������˵���ﵽƽ��״̬��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ���ǣ� ��

A����ӦCH4��H2O![]() 3H2��CO,ÿ����1molCH4ת��12mol ����
3H2��CO,ÿ����1molCH4ת��12mol ����
B���缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
C����ع���ʱ��CO32����缫B�ƶ�
D���缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��B��C��D��E��F�ȼ��ֳ����л���֮���ת����ϵͼ������A����۵���Ҫ�ɷ֣�C��E��Ӧ������F��F������ζ��
![]()
���л����У����Ǿ��Щ�CHO�ṹ�����ʣ������������ʣ�
��1�������Ƶ�������ͭ����Һ��Ӧ������ש��ɫ�ij�����
��2���ڴ����������£���CHO����������Ϊ��COOH������
2R��CHO+O2 ![]() 2R��COOH
2R��COOH
����������Ϣ�������ʵ�ת����ϵ������и��⣺
��1��A�ķ���ʽΪ ��B�к��еĹ������� ����B��Ϊͬ���칹���һ�����ʵ����� ��
��2��A��F�У���������������ͭ����Һ����ש��ɫ�ij����������� ������������
��3��E��С�մ���Һ��Ӧ�����ӷ���ʽΪ ��
��4��C��D�Ļ�ѧ����ʽΪ
��Ӧ����Ϊ ��Ӧ��
��5��C+E��F�Ļ�ѧ����ʽΪ ��
��6��д����������������F������ͬ���칹��Ľṹ��ʽ
����F������ͬ�Ĺ�����
��û��֧����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ������Ũ���ᡢ�廯����������HBr�����Ҵ���Ӧ���Ʊ���������C2H5Br����װ��,��Ӧ��Ҫ����,ͼ��ʡȥ�˼г������װ��,�й����ʵ��������±���


��1���ֱ�д��A��B�������������� �� ��
��2����ȴ��Ӧ�� ���h����i�����ڽ���������C��,�Ʊ�������,�����Ũ�����������ʵ�ϡ��,��Ŀ������ԭ������ ������ĸ����
a.ˮ�Ƿ�Ӧ�Ĵ��� b.����Br2������ c.����HBr�Ļӷ�
��3�����ȵ�Ŀ���� ,ʹ��D������ȴ��ԭ���� ��
��4��A��Һ�����������ɫ�������,д���������Ļ�ѧ����ʽ ,д��A������������Ļ�ѧ����ʽ ��
��5����E�в�Ʒת�뵽��Һ©����,����©���м�������Na2SO3��Һ,���ú��Һ������Na2SO3��Һ��Ŀ���� ,��ҺʱĿ������뿪©���ķ�ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A��Fe2(SO4)3������ˮ����������ˮ��
B��Al2O3�۵�ߣ����������²���
C������ͭ������ǿ������FeCl3��ʴCu����ӡˢ��·��
D��NaHCO3����ˮ�ʼ��ԣ���������ҩ������ʱ��Щ�������ҩЧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���δ�������ҽѧ���δȵġ�ϴԩ��¼�����������鶾�ļ��أ��������鶾���漰�Ļ�ѧ��Ӧ�ǣ�4Ag + 2H2S + O2 �� 2X + 2H2O������˵������ȷ����( )
A��X�Ļ�ѧʽΪAg2S
B����ԭ�ԣ�H2S��H2O
C��ÿ����11.2L O2����Ӧ��ת�Ƶ��ӵ���ĿΪ2NA
D�������۲���ӶԻ������ۣ�H2S�Ŀռ�ṹ��V��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ��ɱ������Ч�ʸߡ�������ȾС��ˮ��������ʵ�����п�ͨ�����·�Ӧ�Ƶã�2KClO3��H2C2O4��H2SO4![]() 2ClO2����K2SO4��2CO2����2H2O������˵������ȷ������ ��
2ClO2����K2SO4��2CO2����2H2O������˵������ȷ������ ��
A��CO2����������
B��H2C2O4�ڷ�Ӧ�б�����
C��H2C2O4��������ǿ��ClO2��������
D��ClO2��ˮ������ʱ����������ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����22.4g������ȫ�ܽ���ijŨ�ȵ������У��練Ӧֻ�ռ���0.2molNO2��0.3molNO������˵����ȷ����
A����Ӧ�����ɵ���ֻ��Fe(NO3)3
B����Ӧ�����ɵ���ֻ��Fe(NO3)2
C����Ӧ�����ɵ���ΪFe(NO3)2��Fe(NO3)3�������ʵ���֮��Ϊ1��3
D����Ӧ�����ɵ���ΪFe(NO3)2��Fe(NO3)3�������ʵ���֮��Ϊ3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ʳ��������Ա仯�ĸ���ԭ���ǣ� ��
A. Ԫ�ص����ԭ���������������������ʱ�
B. Ԫ��ԭ�ӵĺ�������Ų��������Ա仯
C. Ԫ�ص�ԭ�Ӱ뾶�������Ա仯
D. Ԫ�صĻ��ϼ۳������Ա仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com