
 某学习小组为测定市售过氧化钠纯度,设计了如下方案:
某学习小组为测定市售过氧化钠纯度,设计了如下方案: n2(Na2O2)
n2(Na2O2)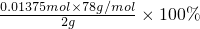 =53.625%
=53.625% 

科目:高中化学 来源: 题型:阅读理解
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(醋酸溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组为测定市售过氧化钠纯度,设计了如下方案:
某学习小组为测定市售过氧化钠纯度,设计了如下方案:查看答案和解析>>
科目:高中化学 来源: 题型:
“百年新药”阿司匹林自问世以来,一直作为解热镇痛药用于头痛、发热、神经痛、风湿热等疾病的治疗,20世纪70年代以后阿司匹林在其它领域的防治功能被逐步开发,如阿司匹林可增进大脑血液循环,对冠心病有预防作用。
药品“阿司匹林泡腾片”说明书上标明:阿司匹林的有效成分是乙酰水杨酸,结构简式为: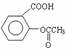 ,每片含乙酰水杨酸0.3g。
,每片含乙酰水杨酸0.3g。
某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定市售阿司匹林的有效成分含量,进行了下列实验探究:
⑴阿司匹林有效成分中羧基和酯基官能团的验证
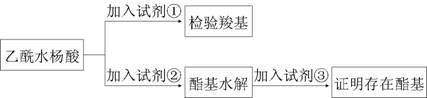
试剂①是________,现象为_________;
该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
⑵市售阿司匹林的有效成分含量的测定
用酸碱滴定法测定市售阿司匹林有效成分的真实含量,实验步骤如下:
①取6片市售阿司匹林药片放入锥形瓶中,再加入1.500mol?L-1的氢氧化钠溶液,为确保阿司匹林和氢氧化钠溶液充分反应,加入1.500mol?L-1的氢氧化钠溶液的体积应大于_____mL。
②将反应后的溶液冷却,加入几滴________,用0.5000mol?L-1的标准盐酸滴定过量的氢氧化钠,至____________________________________。
③重复步骤①和步骤②
问题讨论:
为什么不用氢氧化钠溶液直接滴定乙酰水杨酸_________________________________。
为什么要进行两次滴定?___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
随着流感季节的到来和N1H1的威胁,疫苗的需求空前高涨。尽管那些疫苗是有效的,但美国密苏里州大学研究人员于2009年12月研究发现,一些非处方药,如阿司匹林等抑制某些酶的药物会影响疫苗的效果。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。

回答下列问题:
Ⅰ.(1)上述合成C的路线曾用作有机玻璃单体(![]() )合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得
)合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得![]() ,其化学方程式为: 。
,其化学方程式为: 。
如此改进的优点为: 。
(2)阿司匹林的结构简式为 ,下列物质与阿司匹林互为同分异构体的有 (填字母)。

Ⅱ.某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定阿司匹林的纯度(假设杂质不参加反应),进行了下列实验探究:
(1)阿司匹林有效成分中羧基和酯基官能团的验证

试剂①是________,现象为_________;该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
(2)准确称取阿司匹林a g,粉碎并装入锥形瓶,加水溶解,加入标准浓度C1mol/L的氢氧化钠溶液V1mL,煮沸片刻,使其充分反应。冷却后,用酚酞作指示剂,用C2mol/L盐酸滴定,滴定前盐酸体积为V2mL,滴定终点时盐酸体积为V3mL。(已知:滴定反应是,NaOH+HCl=NaCl+H2O,乙酰水杨酸的相对分子质量为180)
①根据上述数据计算该阿司匹林的纯度为 。
②滴定终点判断“标准”是 ;操作过程中在锥形瓶底垫一张白纸,其作用是 。
③下列操作一定会导致测定结果偏高的是 (填字母)。
A.装盐酸前,滴定管未用标准溶液润洗
B.测定盐酸体积时开始仰视读数,最后俯视读数
C.锥形瓶用标准氢氧化钠溶液润洗
D.滴定过程中盐酸溅到瓶外
E.称量样品时,砝码在左边,而样品放在右边
F.用甲基橙代替酚酞作指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com