
| A、向氯化铝溶液中滴加过量氨水,反应的离子方程式是:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、足量铜与含1mol溶质的浓硫酸反应,可生成0.5molSO2 |
| C、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| D、15.6g过氧化钠与足量二氧化碳充分反应,转移电子数为1.204×1023 |
| 15.6g |
| 78g/mol |
| 15.6g |
| 78g/mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含分子数之比为1:1:1 |
| B、所含氢原子数之比为4:2:3 |
| C、摩尔质量之比为1:1:1 |
| D、质量之比为16:18:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,2LpH=1的H2SO4溶液中,SO42-数目为0.1NA | ||
| B、300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | ||
C、标准状况下,V L CHCl3含有的碳原子数为
| ||
| D、1 mol OH-参与电解,反应过程中转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸亚铁溶液中加入用硫酸酸化过的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
| B、过量的二氧化硫通入漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3 |
| C、向氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,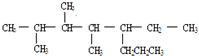 命名为2,3,4-三甲基-5-丙基庚烷 命名为2,3,4-三甲基-5-丙基庚烷 |
| B、邻羟基苯甲醛和对羟基苯甲醛是同分异构体,但邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 |
C、塑化剂的种类很多,其中一种塑化剂的结构简式如图所示.可知该塑化剂该塑化剂在人体内会彻底水解产生2种有机物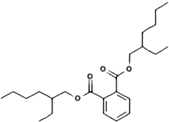 |
D、用甘氨酸(HN2-CH2-COOH)和丙氨酸(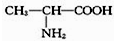 )缩合最多可形成3种二肽 )缩合最多可形成3种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间生成n mol的A2同时生成n mol的AB |
| B、容器内的总压强不随时间变化 |
| C、单位时间生成2n mol的AB同时生成n mol的B2 |
| D、单位时间生成n mol的A2同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(aq) |
| △ |
| CO2 |
| O2 |
| 点燃 |
| H2O |
| 足量CO2 |
| △ |
| HCl(aq) |
| △ |
| 熟石灰 |
| △ |
| H2O、CO2 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com