
| A、25℃时,2LpH=1的H2SO4溶液中,SO42-数目为0.1NA | ||
| B、300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | ||
C、标准状况下,V L CHCl3含有的碳原子数为
| ||
| D、1 mol OH-参与电解,反应过程中转移的电子数为NA |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
| 3 | 900 | a | b | c | d | - |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S+H2SO4(浓)=S↓+SO2↑+2H2O:6e- |
| B、3Cl2+6KOH5KCl+KClO3+3H2O:5e- |
| C、2Na2O2+2H2O=4NaOH+O2↑:2e- |
| D、2H2S+SO2=3S+2H2O:4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氯化铝溶液中滴加过量氨水,反应的离子方程式是:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、足量铜与含1mol溶质的浓硫酸反应,可生成0.5molSO2 |
| C、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| D、15.6g过氧化钠与足量二氧化碳充分反应,转移电子数为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用惰性电极电解MgCl2 溶液:2Cl-+2H2O
| ||||
| B、用浓盐酸酸化的高锰酸钾溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| C、向NH4Al(SO4)2溶液中逐滴加入过量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3?H2O | ||||
| D、向澄清石灰水中滴加同浓度的少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
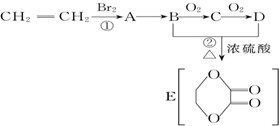
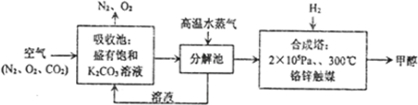
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为: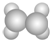 ; ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为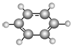 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为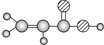 |
查看答案和解析>>
科目:高中化学 来源: 题型:
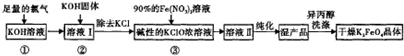
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com