
| A、降低温度 | B、增大压力 |
| C、加入氧气 | D、去掉三氧化硫 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
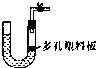
| A、锌粒和稀硫酸制取氧气 |
| B、电石和水制取乙炔 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、大理石和稀硫酸制取二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室常用稀硫酸和石灰石制取CO2 |
| B、实验室可用250mL容量瓶长期贮存0.1mol/L NaCl溶液 |
| C、取5.00mL1.00mol?L-1 盐酸,注入于容积为50mL的容量瓶中,加水稀释至刻度线,即可配得0.100mol?L-1 盐酸 |
| D、用苯萃取碘水中的碘,分液时有机层应从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、如果苯酚浓溶液沾到皮肤上,应立即用稀氢氧化钠溶液清洗 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭 |
| D、蒸发溶液时有液滴飞溅,应立即加水冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1种 | B、3种 | C、5种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
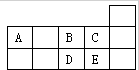 如表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )
如表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )| A、A与B形成的阴离子可能有:AB32-、A2B42- |
| B、E的氢化物的沸点比C的氢化物的沸点低 |
| C、D在过量的B中燃烧的主要产物为DB3 |
| D、这5种元素形成只含极性键的非极性分子多于4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com