
【题目】在一恒温恒容密闭容器中充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )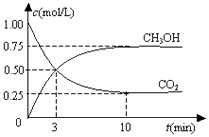
A.反应进行到3 min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.第3 min时,氢气的平均反应速率为1.5mol/(L?min)
D.该温度下,反应的平衡常数的值为 ![]()
【答案】D
【解析】解:A、反应进行到3 min时,各物质的浓度仍在变化,该反应正逆反应不速率相等,没有达到平衡状态,故A错误;
B、平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | |
起始浓度(mol/L) | 1 | 3 | 0 | 0 |
变化浓度(mol/L) | 0.75 | 2.25 | 0.75 | 0.75 |
平衡浓度(mol/L) | 0.25 | 0.75 | 0.75 | 0.75 |
从反应开始到平衡,CO2的转化率= ![]() =75%,故B错误;
=75%,故B错误;
C、第3 min二氧化碳的平均反应速率v= ![]() =
= ![]() mol/(Lmin),各个物质表示的速率之比等于系数之比来,所以氢气的平均反应速率是0.5mol/(Lmin),故C错误;
mol/(Lmin),各个物质表示的速率之比等于系数之比来,所以氢气的平均反应速率是0.5mol/(Lmin),故C错误;
D、平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | |
起始浓度(mol/L) | 1 | 3 | 0 | 0 |
变化浓度(mol/L) | 0.75 | 2.25 | 0.75 | 0.75 |
平衡浓度(mol/L) | 0.25 | 0.75 | 0.75 | 0.75 |
K= ![]() =
= ![]() =
= ![]() ,故D正确.
,故D正确.
故选D.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的是溶液变绿的原因,写出产生该物质的电极反应式:。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl ![]() [CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因:。
[CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因:。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是 , 否定乙的依据是。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]_ , [CuCl2]_掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]_的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是。
② 写出b中生成[CuCl2]_的离子方程式:。
③ 补充c中必要的操作及现象:。
丙据此得出结论:电解时阴极附近生成[CuCl2]_是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2. 
(1)则溶液中含有的阳离子有 .
(2)写出图2曲线a~b段反应的离子方程式 , .
(3)A溶液中存在的阳离子的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,所用仪器合理的是( )
A.用25mL的碱式滴定管量取14.80mLNaOH溶液
B.用100mL量筒量取5.2mL的盐酸
C.用托盘天平称取25.20gNaCl
D.用100mL容量瓶配制50mL1.0mol/L盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是指粒子直径在几纳米到几十纳米的材料.若将“纳米材料”的粒子分散到液体分散剂中所得到的分散系是( )
A.溶液
B.胶体
C.悬浊液
D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的标准燃烧热为890.3 kJ?mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ?mol﹣1
B.已知:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
C.已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 kJ?mol﹣1
D.已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH﹣(aq)?H2O(l)
△H=﹣57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=﹣114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式. 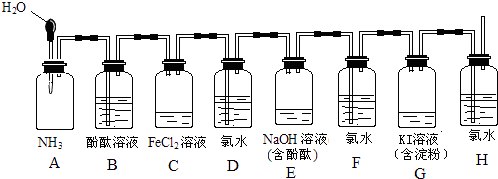
(1)A中的现象为 , 化学方程式 .
(2)C中的现象为 , 离子方程式 .
(3)E中的现象为 , 离子方程式 .
(4)G中的现象为 , 离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的特征是( )
A.胶体粒子直径在1nm~100nm之间B.胶体粒子带电荷
C.胶体粒子不能穿过半透膜D.胶体粒子能够发生布朗运动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com