
【题目】下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是
A. 铝热反应 B. 铝与盐酸反应
C. Ba(OH)2·8H2O晶体和NH4Cl晶体反应 D. 灼热的炭与CO2反应
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl═NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:

(1)酸性:HNO3>H2CO3>H2SiO3
A、B、C中装试剂分别为_______;C中实验现象为______________________;
写出C中发生反应的离子方程式____________________________.
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性.则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂_______,C中现象_______________,写出B中反应的离子方程式___________________________.
(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,写出化学方程式______;证明氯的非金属性比硫的非金属性______(填“强”或“弱”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25.00ml碱式滴定管中盛有溶液,液面恰好在20.00ml刻度处,现将滴定管中全部溶液放出,流入量筒内,所得溶液体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是( )


A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应8~12 min间的平均反应速率和推测反应20 min时反应物的浓度,结果应是( )

A. 1.25 μmol·L-1·min-1和1.25 μmol·L-1
B. 2.5 μmol·L-1·min-1和2.5 μmol·L-1
C. 3.0 μmol·L-1·min-1和3.0 μmol·L-1
D. 5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0.
2SO3(g) ΔH<0.
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )

A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ 表示的是温度对平衡的影响,且T甲小于T乙
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
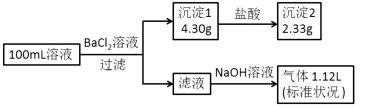
下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)

(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com