
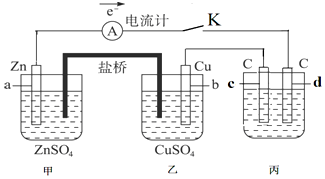
分析 (1)甲和乙形成原电池,所以丙有外加电源,属于电解池;甲中a失电子为负极;丙中c电极连接原电池的正极属于阳极;
(2)乙中Cu极上阳离子得电子;根据电子与Zn的物质的量关系求算;
(3)丙池中是电解NaCl溶液生产氢气,氯气和氢氧化钠;
(4)要给丙中铁片上镀上一层Cu,则阳极应该为Cu电极,电解质溶液为硫酸铜溶液.
解答 解:(1)甲和乙形成原电池,所以丙有外加电源,属于电解池;甲中a失电子为负极;丙中c电极连接原电池的正极属于阳极;
故答案为:电解池;负极;阳极;
(2)乙中Cu极上铜离子得电子生成铜单质,其电极反应为:Cu2++2e-=Cu;Zn从0价升高到+2价失去2个电子,已知电路中有0.02mol电子通过,所以消耗的Zn为0.01mol,m(Zn)=nM=65g/mol×0.01mol=0.65g;
故答案为:Cu2++2e-=Cu;0.65;
(3)丙池中是电解NaCl溶液生产氢气,氯气和氢氧化钠,其电解方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)要给丙中铁片上镀上一层Cu,则阳极应该为Cu电极,电解质溶液为硫酸铜溶液,所以要把C电极换成Cu电极,把NaCl溶液换为硫酸铜溶液;
故答案为:把C电极换成Cu电极,把NaCl溶液换为硫酸铜溶液.
点评 本题综合考查原电池和电解池知识,题目难度中等,注意把握原电池和电解池原理,题目有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,提高学生学习效率.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
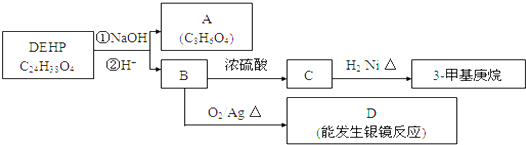
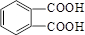 +n HOCH2CH2OH
+n HOCH2CH2OH
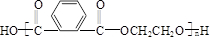 +(2n-1)H2O.
+(2n-1)H2O.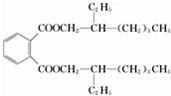 .
.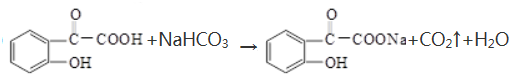 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
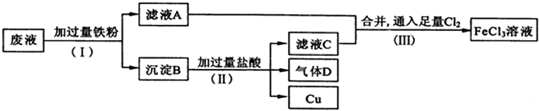
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
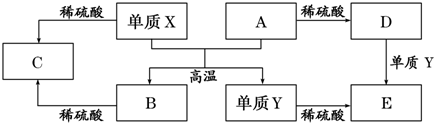
| A. | 单质Y在一定条件下能与水发生置换反应 | |
| B. | 向D溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | X与A反应的化学方程式是 Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能与酸反应所以均是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol OH-与1mol-OH所含质子数均为9NA | |
| B. | pH=1的H2SO4溶液含H+的数目为0.2NA | |
| C. | 273K,101kPa条件下,14g乙烯与丙烯的混合物中含有的碳原子数目为3NA | |
| D. | 标准状况下,11.2L CCl4含有C-Cl键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些金属、非金属元素化合时也能形成共价键 | |
| B. | 只有阴、阳离子间才能形成离子键 | |
| C. | 升温能加快钠与氧气反应生成氧化钠反应的速率 | |
| D. | FeCl2不能通过两种单质化合反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5 NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于C | B. | 小于C | C. | 等于C | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com