
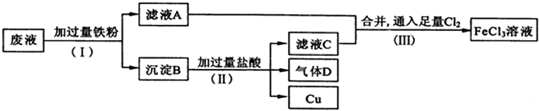
分析 从腐蚀废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,由流程可知,应加入过量的Fe与氯化铁、氯化铜反应生成氯化亚铁、铜,过滤进行分离,则滤液A为FeCl2,沉淀B中含Fe、Cu,加过量盐酸,铁溶解,产生氯化亚铁和氢气,过滤得到金属Cu,滤液C中含FeCl2、HCl,为不引人杂质,将铁的化合物全部转化为FeCl3溶液,则通入足量氯气进行氧化,据此解答.
解答 解:从腐蚀废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,由流程可知,应加入过量的Fe与氯化铁、氯化铜反应生成氯化亚铁、铜,过滤进行分离,则滤液A为FeCl2,沉淀B中含Fe、Cu,加过量盐酸,铁溶解,产生氯化亚铁和氢气,过滤得到金属Cu,滤液C中含FeCl2、HCl,为不引人杂质,将铁的化合物全部转化为FeCl3溶液,则通入足量氯气进行氧化.
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是过滤,故答案为:过滤;
(2)由流程分析可知沉淀B中含过量的铁和产生的铜,铁与盐酸反应产生氢气,故答案为:铜;氢气;
(3)通入Cl2全部转化为FeCl3,发生反应:2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3;
(4)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在,故答案为:KSCN溶液.
点评 本题考查混合物的分离、提纯综合应用,明确工艺流程原理,掌握元素化合物的性质是关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
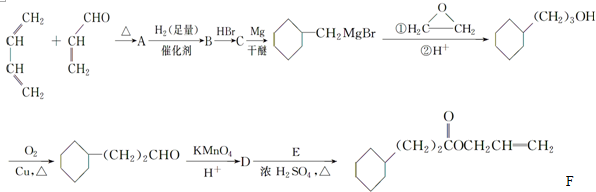
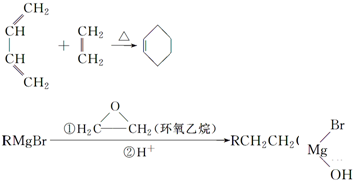
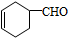
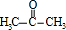 .
. .
.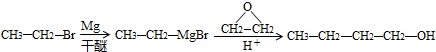 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
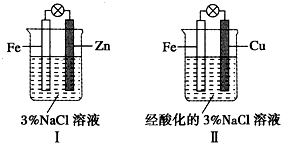
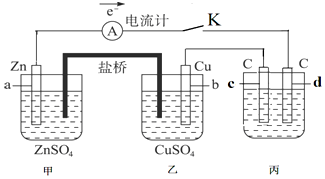
| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
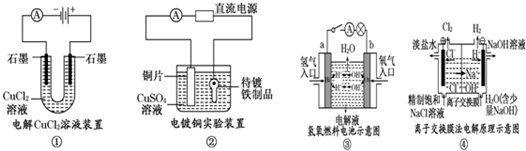
| A. | 装置①中阳极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中外电路电子由a极流向b极 | |
| D. | 装置④的阳极反应为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | CO | C. | H2 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
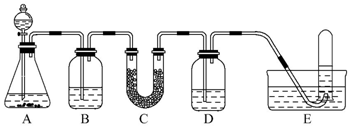
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com