
【题目】利用如图装置(略去部分夹持仪器,气密性已检验)生产硫代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。

已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是( )
A.应用装置①,利用H2O2和MnO2可制备少量O2
B.装置③中Na2S和Na2SO3的物质的量之比最好为1:2
C.实验过程中,装置②和装置④的作用相同
D.装置⑤中盛有NaOH溶液,可吸收多余的尾气
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
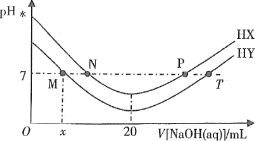
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
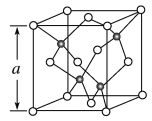
【题目】(1)Cu的一种氯化物晶胞结构如图所示(黑球表示铜原子,白球表示氯原子),该氯化物的化学式是__。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数的值,则该晶胞的边长a=__nm。
(2)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
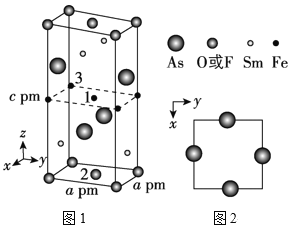
图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为__,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=__g·cm-3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ,
,![]() ,
,![]() ),则原子2和3的坐标分别为__、__。
),则原子2和3的坐标分别为__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:

(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为____。
(2)上述流程中采用稀碱液比用热水更好,理由是___________。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)=___mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x=___,pH控制在___范围。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有_____。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为2:5
D.标准状况下若生成2.24LN2则转移电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙胺卡因(H)是一种局部麻醉药物,实验室制备H的一种合成路线如下:
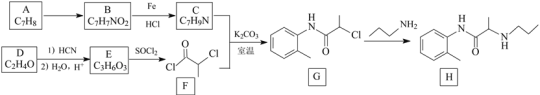
已知:![]()
![]()
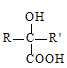 (R和R'为烃基或H)
(R和R'为烃基或H)
回答下列问题:
(1)B的化学名称是___________,H的分子式是____________。
(2)C中所含官能团的名称为_______________,由G生成H的反应类型是___________。
(3)C与F反应生成G的化学方程式为___________。反应中使用K2CO3的作用是_______。
(4)化合物X是E的同分异构体,X能与NaOH溶液反应,其核磁共振氢谱只有1组峰。X的结构简式为________。
(5)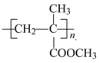 (聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮(CH3COCH3)和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线___________。(无机试剂任选)
(聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮(CH3COCH3)和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线___________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将![]() 溶液用
溶液用![]() 盐酸滴定时,若用酚酞做指示剂,终点时消耗盐酸
盐酸滴定时,若用酚酞做指示剂,终点时消耗盐酸![]() ;若用甲基橙做指示剂,终点时消耗盐酸
;若用甲基橙做指示剂,终点时消耗盐酸![]() 。现有一份白色粉末,可能含有
。现有一份白色粉末,可能含有![]() 、
、![]() 、
、![]() 的一种或两种。现取一定量的该粉未配成适当浓度的稀溶液并分成两等份,分别用
的一种或两种。现取一定量的该粉未配成适当浓度的稀溶液并分成两等份,分别用![]() 盐酸滴定。一份用酚酞做指示剂,消耗盐酸
盐酸滴定。一份用酚酞做指示剂,消耗盐酸![]() ;另一份用甲基橙做指示剂,消耗盐酸
;另一份用甲基橙做指示剂,消耗盐酸![]() 。下列说法正确的是( )
。下列说法正确的是( )
①若![]() ,则固体中只含有
,则固体中只含有![]()
②若![]() ,则固体中只含
,则固体中只含![]()
③若![]() ,则固体中含有
,则固体中含有![]() 、
、![]()
④若![]() ,则固体中含有
,则固体中含有![]() 、
、![]()
A.①②③④B.③④C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com