
【题目】下图中A~J均代表无机物或其水溶液,其中A是红色固体,H是生活中常见的液体,J是磁性材料,而B、D、G是单质,B是地壳中含量最高的金属元素,G是气体。根据图示回答问题:
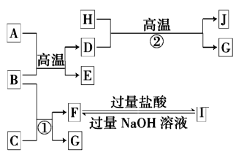
(1)写出下列物质的化学式:A_______,I___________。
(2)反应②的化学方程式是____________。
(3)上述物质D可与硫酸反应生成FeSO4,利用FeSO4可制得一种高效净水剂。方程式如下,若FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式______:FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑。
(4)高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾作为水处理剂发挥的作用是____、____。
(5)氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如下:回答下列问题:
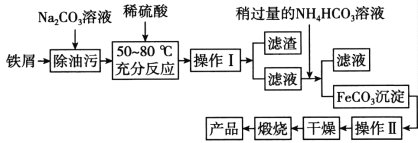
①操作I、Ⅱ的名称分别是_____、_________。
②加入NH4HCO3溶液后过滤,所得滤液的主要成份是:_________。
③写出在空气中锻烧FeCO3的化学方程式________;
(6)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定:a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为_____。
【答案】Fe2O3 AlCl3 3Fe + 4H2O(g) ![]() Fe3O4 + 4H2 2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑ 强氧化性 吸附净水 过滤 洗涤 硫酸铵 4FeCO3 + O2
Fe3O4 + 4H2 2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑ 强氧化性 吸附净水 过滤 洗涤 硫酸铵 4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2 97.54%
2Fe2O3 + 4CO2 97.54%
【解析】
J是磁性材料即为四氧化三铁,推出D为铁,H为水,G为氢气,B是地壳中含量最高的金属元素即为铝,根据A和B反应,和A的颜色,推出A为氧化铁,G是气体,根据F到I的反应可知F为偏铝酸根,I为铝离子,C为强碱。
纯碱主要是利用水解原理去除油污,铁和稀硫酸反应生成硫酸亚铁,过滤后,向滤液中加入过量的碳酸氢铵,发生反应生成碳酸亚铁、硫酸铵、二氧化碳气体,再过滤洗涤干燥,再空气中煅烧得到氧化铁。
⑴写出下列物质的化学式A:Fe2O3,I:AlCl3,
故答案为Fe2O3;AlCl3;
⑵反应②是铁和水蒸气再高温下反应,其化学方程式是3Fe + 4H2O(g) ![]() Fe3O4 + 4H2,
Fe3O4 + 4H2,
故答案为3Fe + 4H2O(g) ![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
⑶若FeSO4和O2的化学计量数之比为2∶1,利用化合价升降守恒,2个铁升高8个价态,得到1个氧气升高2个价态,共升高10个价态,降低也应该降低10个价态,因此方程式配平为2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑,
故答案为2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑;
⑷高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾化合价降低,具有强的氧化性,生成的氢氧化铁胶体具有吸附性,吸附水中的杂质,因此高铁酸钾作为水处理剂发挥的作用是强氧化性、吸附净水,
故答案为强氧化性;吸附净水;
⑸①根据操作I后面滤渣可推出该步骤为过滤,根据操作Ⅱ后面干燥可知该步骤为洗涤,
故答案为过滤;洗涤;
②加入NH4HCO3溶液和硫酸亚铁反应生成碳酸亚铁和硫酸铵,所得滤液的主要成份是硫酸铵,
故答案为硫酸铵;
③在空气中锻烧FeCO3的反应生成氧化铁和二氧化碳气体,其化学方程式4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2,
2Fe2O3 + 4CO2,
故答案为4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2;
2Fe2O3 + 4CO2;
⑹5FeSO4 ——KMnO4,根据关系得出硫酸亚铁的物质的量![]() ,
,
质量分数为![]() ,
,
故答案为97.54%。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)为白色结晶粉末,易溶于水,在中性或碱性条件下稳定,在酸性条件下发生反应(S2O32-+2H+=S↓+SO2+H2O),是一种重要的化工原料。请回答下列问题:
(1)Na2S2O3溶液可用作照相底片(AgBr)中的定影剂,其原理是将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。写出该络合反应的离子方程式___。
(2)工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。巳知该反应中C(碳)原子化合价不变,则氧化剂和还原剂物质的量之比为___。
(3)Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,设计实验方案检验Na2S2O3是否变质(已知BaS2O3微溶于水)___。
(4)现有含Na2S2O3·5H2O的样品,用以下方法计算Na2S2O3·5H2O的质量分数。
a.取样品7.0g溶于蒸馏水中,并定容至500mL容量瓶中待用。
b.取0.01mol.L-1的K2Cr2O7标准溶液20.00mL于锥形瓶中,加过量KI溶液并酸化,加2滴淀粉指示剂,用a中未知浓度的Na2S2O3待测液滴定至终点,共用去25.00mL。(已知2S2O32-+I2=S4O62-+2I-),在酸性环境中Cr2O72-被还原为绿色的Cr3+)。
回容下列问题:
①滴定终点的现象是___。
②样品中Na2S2O3·5H2O的质量分数为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是
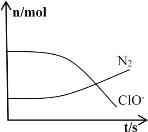
A. 该反应中Cl-为氧化产物
B. 消耗1mol还原剂,转移6mol电子
C. NH4+被ClO-氧化成N2
D. 反应后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补齐下列物质间的反应与对应反应类型的连线。
A. 从乙烯得到聚乙烯的反应 | a. 氧化反应 |
B. 乙醇与酸性重铬酸钾溶液反应 | b. 加聚反应 |
C. 乙烯与溴的四氯化碳溶液反应 | c. 取代反应 |
D. 乙酸和乙醇在浓硫酸作用下的反应 | d. 加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空:
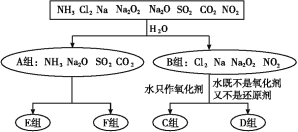
(1)上述分类中,分成A、B两组的依据是_________。
(2)D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有__(填化学式)。
(3)实验室由Al3+制备Al(OH)3时,应选择F组中_____(填化学式)的水溶液,离子方程式为______。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___,②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,B苯环上的一硝基取代物有三种,有关物质之间的转化关系如下:
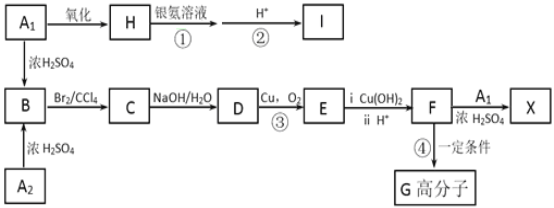
⑴D的分子式为_________________,I中官能团结构简式为_______________________,反应④的反应类型为________________。
⑵写出下列物质的结构简式:A2___________________;X __________________。
⑶写出下列反应的化学方程式:①_______________________________。
⑷化合物J是比化合物E多一个碳原子的E的同系物,化合物J有多种同分异构体,其中同时满足下列条件的同分异构体有___________________种;
①苯环上有两个取代基; ②能使FeCl3溶液显色; ③与E含有相同官能团
写出其中核磁共振氢谱图中峰面积比为1:1:2:2:6的结构简式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲组同学设计的实验装置如图所示,回答下列问题:
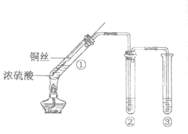
(1)试管①中反应的化学方程式是____________ 。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是____________。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,回答问题。
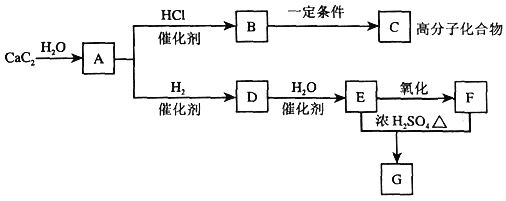
(1)B中所含官能团的名称是:_______。
(2)反应B→C的化学方程式是________;反应D→E的化学方程式是_______。
(3)B→C的反应类型属于______。
(4)写出实验室制取A的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )
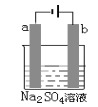
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com