
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )
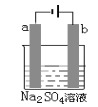
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
科目:高中化学 来源: 题型:
【题目】下图中A~J均代表无机物或其水溶液,其中A是红色固体,H是生活中常见的液体,J是磁性材料,而B、D、G是单质,B是地壳中含量最高的金属元素,G是气体。根据图示回答问题:
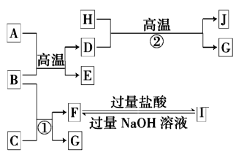
(1)写出下列物质的化学式:A_______,I___________。
(2)反应②的化学方程式是____________。
(3)上述物质D可与硫酸反应生成FeSO4,利用FeSO4可制得一种高效净水剂。方程式如下,若FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式______:FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑。
(4)高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾作为水处理剂发挥的作用是____、____。
(5)氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如下:回答下列问题:
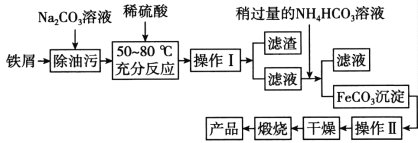
①操作I、Ⅱ的名称分别是_____、_________。
②加入NH4HCO3溶液后过滤,所得滤液的主要成份是:_________。
③写出在空气中锻烧FeCO3的化学方程式________;
(6)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定:a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确且能合理解释亊实的是
A. SO2随雨水降落.形成酸雨:SO2+ H2O = 2H+ + SO32-
B. 向Mg(HCO3)2溶液中加人过量NaOH溶液,产生白色沉淀:Mg2+ +2HCO3- +2OH -= MgCO3↓+2H2O
C. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置—段时间后,溶液变蓝: 4H++4I-+O2=2I2+2H2O
D. Cl2通入FeCl2 溶液中生成 FeCl3:Fe2++Cl2=2Cl-+Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实、离子方程式及其对应关系均正确的是( )
A. 铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-=== Fe3++NO↑+2H2O
B. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
C. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I+O2 === 2I2+2H2O
D. 向水杨酸(![]() )中滴加NaHCO3溶液,放出无色气体:
)中滴加NaHCO3溶液,放出无色气体:![]() +2HCO3-
+2HCO3-![]()
![]() +2CO2↑+2H2O
+2CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时某气态烃与O2混合充入密闭容器中,点燃后又恢复至25℃,此时容器内压强为原来的![]() ,再经NaOH溶液处理,容器内几乎成为真空,该烃的化学式为( )
,再经NaOH溶液处理,容器内几乎成为真空,该烃的化学式为( )
A.CH4B.C2H6C.C3H8D.C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入某密闭容器中,发生如下反应:![]() 。请回答下列问题:
。请回答下列问题:
(1)若容器体积固定为2L
①反应1min时测得剩余1.8mol A,C的浓度为0.4mol/L.1min内,B的平均反应速率为 ____________;x= ________
②若反应2min达到平衡,平衡时C的浓度 ______ (填“大于”“等于”或“小于”)0.8mol/L
③平衡混合物中,C的体积分数为22%,则A的转化率是 ______ ![]() 保留3位有效数字
保留3位有效数字![]()
(2)一定温度下,可逆反应:![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是 ______
在体积固定的密闭容器中反应,达到平衡状态的标志是 ______
①单位时间内生成nmolO2,同时生成2nmolNO
②用NO、O2、NO2的物质的量浓度变化表示的反应速率的比:2:1:2
③混合气体的密度不随时间的变化而变化
④O2的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ,反应过程中测定的部分数据见表(表中t2>t1):
CO2(g)+H2(g) ,反应过程中测定的部分数据见表(表中t2>t1):
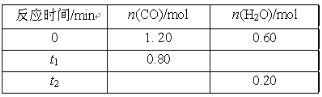
下列说法正确的是
A.增大压强对正逆反应速率没有影响,平衡不移动
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O(g),达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.由表格中数据得出,t1时刻该反应还未达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
实验一:合成碳酸镁晶体的步骤:
①配制一定浓度的MgSO4溶液和NH4HCO3溶液;
②量取一定量的NH4 HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;
③用氨水调节溶液pH至9.5,放置一段时间后,过滤、洗涤、干燥得碳酸镁晶体产品。
称取3.000gMgSO4样品配制250mL溶液流程如图所示:
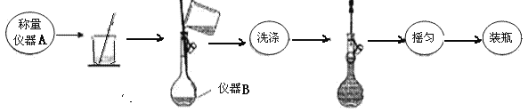
回答下列问题:
(1)写出实验仪器名称:A_____;B_____。配制溶液过程中定容后的“摇匀”的实验操作为______。
(2)检验碳酸镁晶体是否洗干净的方法是_________。
实验二:测定产品MgCO3·nH2O中的n值(仪器和药品如图所示):
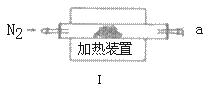
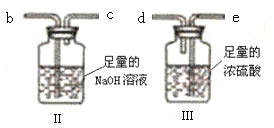
(3)实验二装置的连接顺序为_____(按气流方向,用接口字母abcde表示),其中Ⅱ装置的作用是_____。
(4)加热前先通入N2排尽装置Ⅰ中的空气,然后称取装置Ⅱ、Ⅲ的初始质量。进行加热时还需通入N2的作用是______。
(5)若要准确测定n值,至少需要下列所给数据中的_____(填选项字母),写出相应1种组合情景下,求算n值的数学表达式:n=______。
a.装置Ⅰ反应前后质量差m1 b.装置Ⅱ反应前后质量差m2 c.装置Ⅲ反应前后质量差m3
查看答案和解析>>
科目:高中化学 来源: 题型:
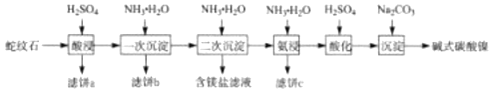
【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com