
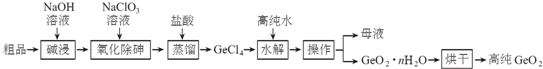
分析 二氧化锗粗品(主要含GeO2、As2O3)中加入NaOH溶液碱浸,发生的反应为GeO2+2NaOH═Na2GeO3+H2O、As2O3+2NaOH═2NaAsO2+H2O,向溶液中加入NaClO3氧化除砷,发生的反应为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,向溶液中加入稀盐酸并蒸馏,“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O,所以得到GeCl4,向GeCl4中加入高纯水,发生的水解反应为GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl,然后过滤得到母液和GeO2•n H2O,将GeO2•n H2O烘干得到高纯的GeO2,
(1)锗的原子序数为32,锗在元素周期表中的位置为第四周期IVA族;
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,同时氯酸钠被还原生成氯化钠,根据反应物和生成物书写反应方程式;
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,馏出物中将会含有AsCl3;
(4)工业上与蒸馏操作相关的设备有蒸馏釜和冷凝塔;
(5)“水解”时生成GeO2•n H2O和HCl,温度高时GeCl4易挥发,且该反应是放热反应,升高平衡平衡逆向移动;
(6)1吨二氧化锗粗品(含杂质30%)中杂质质量=1t×30%=0.3t,纯的二氧化锗质量=1t×(1-30%)=0.7t,实际上经提纯得0.745吨的高纯二氧化锗产品,则提纯得到的二氧化锗中杂质质量=(0.745-0.7)t=0.045t,据此计算杂质去除率.
解答 解:二氧化锗粗品(主要含GeO2、As2O3)中加入NaOH溶液碱浸,发生的反应为GeO2+2NaOH═Na2GeO3+H2O、As2O3+2NaOH═2NaAsO2+H2O,向溶液中加入NaClO3氧化除砷,发生的反应为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,向溶液中加入稀盐酸并蒸馏,“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O,所以得到GeCl4,向GeCl4中加入高纯水,发生的水解反应为GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl,然后过滤得到母液和GeO2•n H2O,将GeO2•n H2O烘干得到高纯的GeO2,
(1)锗的原子序数为32,锗在元素周期表中的位置为第四周期IVA族,故答案为:四;IVA;
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,同时氯酸钠被还原生成氯化钠,根据反应物和生成物书写反应方程式为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,故答案为:3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O;
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是馏出物中将会含有AsCl3,降低了产品纯度,故答案为:馏出物中将会含有AsCl3,降低了产品纯度;
(4)工业上与蒸馏操作相关的设备有蒸馏釜和冷凝塔,故选AC;
(5)“水解”时生成GeO2•n H2O和HCl,反应方程式为GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl,该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率,所以采用低温水解,故答案为:GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl;该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率;
(6)1吨二氧化锗粗品(含杂质30%)中杂质质量=1t×30%=0.3t,纯的二氧化锗质量=1t×(1-30%)=0.7t,实际上经提纯得0.745吨的高纯二氧化锗产品,则提纯得到的二氧化锗中杂质质量=(0.745-0.7)t=0.045t,杂质去除率=$\frac{(0.3-0.045)t}{0.3t}$×100%=85%,
故答案为:85%.
点评 本题考查物质制备,为高频考点,涉及元素周期表结构及其应用、盐类水解、氧化还原反应等知识点,明确化学反应原理、基本操作、物质性质是解本题关键,知道流程图中发生的反应及基本操作方法,侧重考查学生知识综合应用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容摇匀后,有少量溶液外流,则NaClO的物质的量浓度偏小 | |
| B. | 容量瓶用蒸馏水洗净后可以不烘干即能用于溶液的配制 | |
| C. | 所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 | |
| D. | 所配制NaClO溶液的物质的量浓度为2.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和钾合金在常温下是液体,可用于快中子反应堆的热交换剂 | |
| B. | 镁合金密度小但强度大,大量用于火箭、飞机的部件等 | |
| C. | 高炉炼铁得到含碳0.03%~2%的生铁 | |
| D. | 生物炼铜是利用能耐受铜盐毒性的细菌将不溶性硫化铜转化为可溶性铜盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子2个δ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子存在非极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 9 | C. | 8 | D. | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com