
| A. | 钠和钾合金在常温下是液体,可用于快中子反应堆的热交换剂 | |
| B. | 镁合金密度小但强度大,大量用于火箭、飞机的部件等 | |
| C. | 高炉炼铁得到含碳0.03%~2%的生铁 | |
| D. | 生物炼铜是利用能耐受铜盐毒性的细菌将不溶性硫化铜转化为可溶性铜盐 |
分析 A、钠钾合金为液态,作原子反应堆作热交换剂;
B、合金密度小、强度大;
C、根据已有的知识进行分析,生铁是铁和碳的合金,其中碳占2%~4.3%,据此解答;
D、微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石.
解答 解:A、钠钾合金为液态,可作快中子反应堆作热交换剂,故A正确;
B、合金密度小、强度大、熔点高,所以镁合金能应用于火箭、飞机等部件,故B正确;
C、生铁是铁和碳的合金,其中生铁中碳占2%~4.3%,故C错误;
D、把不溶性的硫化铜氧化,硫从负二价被氧化成正六价,故最后转化成可溶的硫酸铜,故D正确;
故选C.
点评 本题考查了镁的性质及应用,钾钠合金和铁的合金以及生物炼钢,综合性强,但比较容易,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 明矾、氯化铁晶体常用于净水或消毒 | |
| B. | 实验室通常使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 加热稀醋酸溶液其pH稍有减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
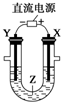
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度不变 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 制取金属镁时,Z是熔融的氯化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
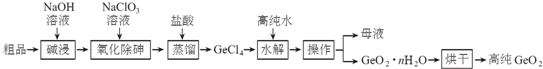
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图为某市售浓盐酸试剂瓶标签上的部分数据.
图为某市售浓盐酸试剂瓶标签上的部分数据.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 铁与盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 硫酸与氢氧化钡混合:2H++SO42-+Ba2++2OH?═Ba SO4↓+2 H2O | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 0.2 mol•L-1的醋酸(CH3COOH)溶液与0.1 mol•L-1NaOH溶液等体积混合后:c(CH3COO-)+2 c(OH-)=c(CH3COOH)+2c(H+) | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com