
ΓΨΧβΡΩΓΩΦΉ¥Φ”κΥ°’τΤχ÷Ί’ϊ÷Τ«βΩ…÷±Ϋ””Ο”Ύ»ΦΝœΒγ≥ΊΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©“―÷ΣΘΚΦΉ¥ΦΖ÷ΫβΖ¥”ΠΘΚCH3OH(g)![]() CO(g)ΘΪ2H2(g) ΓςH1ΘΫ________ kJΓΛmolΘ≠1Υ°’τΤχ±δΜΜΖ¥”ΠΘΚCO(g)ΘΪH2O(g)
CO(g)ΘΪ2H2(g) ΓςH1ΘΫ________ kJΓΛmolΘ≠1Υ°’τΤχ±δΜΜΖ¥”ΠΘΚCO(g)ΘΪH2O(g)![]() CO2(g)ΘΪH2(g) ΓςH2ΘΫΘ≠41Θ°20 kJΓΛmolΘ≠1Θ§‘ρCH3OHΘ®gΘ©ΘΪH2OΘ®gΘ©
CO2(g)ΘΪH2(g) ΓςH2ΘΫΘ≠41Θ°20 kJΓΛmolΘ≠1Θ§‘ρCH3OHΘ®gΘ©ΘΪH2OΘ®gΘ©![]() CO2Θ®gΘ©ΘΪ3H2Θ®gΘ©ΓςH3ΘΫ+49.44kJΓΛmolΘ≠1ΓΘ
CO2Θ®gΘ©ΘΪ3H2Θ®gΘ©ΓςH3ΘΫ+49.44kJΓΛmolΘ≠1ΓΘ
Θ®2Θ©ΩΤ―ßΦ“Ά®ΙΐΟήΕ»ΖΚΚ·άμ¬έ―–ΨΩΦΉ¥Φ”κΥ°’τΤχ÷Ί’ϊ÷Τ«βΖ¥”ΠΜζάμ ±Θ§ΒΟΒΫΦΉ¥Φ‘ΎPdΘ®ΔσΘ©±μΟφΖΔ…ζΫβάκ ±ΥΡΗω¬ΖΨΕ”κœύΕ‘ΡήΝΩΙΊœΒ»γΆΦΥυ ΨΘ§Τδ÷–ΗΫ‘ΎPdΘ®ΔσΘ©±μΟφΒΡΈο÷÷”Ο*±ξΉΔΓΘ¥Υάζ≥Χ÷–ΜνΜ·ΡήΉν–ΓΒΡΖ¥”ΠΖΫ≥Χ ΫΈΣ_________________________ΓΘ
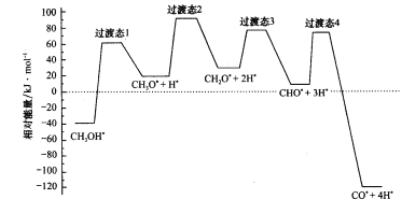
Θ®3Θ©‘Ύ0.1MPaœ¬Θ§ΫΪΉήΫχΝœΝΩ1 mol«“nΘ®CH3OHΘ©ΘΚnΘ®H2OΘ©ΘΫ1ΘΚ1.3ΒΡΜλΚœΤχΧε≥δ»κ“ΜΗ’–‘Οή±’»ίΤς÷–Ζ¥”ΠΓΘ
ΔΌ Β―ι≤βΒΟΥ°ΟΚΤχ±δΜΜΖ¥”ΠΒΡΥΌ¬ ΥφΈ¬Ε»ΒΡ…ΐΗΏΟςœ‘œ¬ΫΒΘ§‘≠“ρ «__________ΓΘ
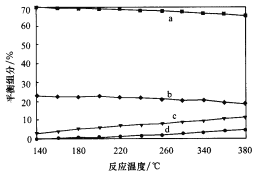
ΔΎΤΫΚβ ±Θ§≤βΒΟCH3OHΒΡΚ§ΝΩ‘ΎΗχΕ®Έ¬Ε»ΖΕΈßΡΎΦΪ–ΓΘ§H2ΓΔH2OΘ®gΘ©ΓΔCOΓΔCO2ΥΡ÷÷ΉιΖ÷Κ§ΝΩ”κΖ¥”ΠΈ¬Ε»ΙΊœΒ»γΆΦΥυ ΨΘ§ ‘Ϋβ ΆaΒΡΚ§ΝΩ‘Φ «cΒΡΚ§ΝΩ3±ΕΒΡ‘≠“ρ__________ΓΘ
Θ®4Θ©297 K ±Θ§œρΟή±’»ίΤςΔώ(ΧεΜΐΈΣ4LΘ©ΚΆΔρΘ®ΧεΜΐΈΣ8LΘ©÷–Ζ÷±π≥δ»κœ¬Ν–Έο÷ ΖΔ…ζΖ¥”ΠΘ§
±ύΚ≈ | CO(mol) | H2(mol) | CH3OH(mol) |
Δώ | 4 | a | 0 |
Δρ | 4 | 4 | 4 |
¥οΤΫΚβ ±ΝΫΗω»ίΤς÷–c(H2)œύΒ»«“c(H2)=0.5mol/LΓΘ‘ρ
ΔΌa=_____________ΓΘ
ΔΎΗΟΈ¬Ε» ±Θ§Δώ÷–Ζ¥”ΠΒΡK=___________ΓΘ
ΔέΔρ÷–Α¥±μΗώ ΐΨί≥δ»κΖ¥”ΠΈο¥Υ ±Ζ¥”ΠΒΡΖΫœρ__________Θ®ΧνΓΑ’ΐœρΫχ––Γ±ΓΔΓΑΤΫΚβΓ±ΜρΓΑΡφœρΫχ––Γ±Θ©ΓΘ
ΓΨ¥πΑΗΓΩ90.64 CH2O*+2H*=CHO*+3H* (ΜρCH2O*=CHO*+H*) ΥφΈ¬Ε»…ΐΗΏΘ§¥ΏΜ·ΦΝΜν–‘ΫΒΒΆ aΈΣ«βΤχΘ§cΈΣCO2Θ§Εΰ’Ώ «Ά®ΙΐΖ¥”ΠCH3OHΘΪH2O ![]() CO2ΘΪ3H2 …ζ≥…Θ§«βΤχΒΡΚ§ΝΩ «Εΰ―θΜ·ΧΦΒΡ3±Ε 6 0.25 ΤΫΚβ
CO2ΘΪ3H2 …ζ≥…Θ§«βΤχΒΡΚ§ΝΩ «Εΰ―θΜ·ΧΦΒΡ3±Ε 6 0.25 ΤΫΚβ
ΓΨΫβΈωΓΩ
(1)ΦΉ¥ΦΖ÷ΫβΖ¥”ΠΘΚCH3OH(g) ![]() CO(g)+2H2(g) ΓςH1ΔΌΘ§Υ°’τΤχ±δΜΜΖ¥”ΠΘΚCO(g)+H2O(g)
CO(g)+2H2(g) ΓςH1ΔΌΘ§Υ°’τΤχ±δΜΜΖ¥”ΠΘΚCO(g)+H2O(g) ![]() CO2(g)+H2(g) ΓςH2=-41.20 kJ/molΔΎΘ§CH3OH(g)+H2O(g)
CO2(g)+H2(g) ΓςH2=-41.20 kJ/molΔΎΘ§CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΓςH3ΘΫ+49.44kJΓΛmolΘ≠1ΔέΘ§ΗυΨίΗ«ΥΙΕ®¬…ΔΌ=Δέ-ΔΎΘ§Φ¥Ω…«σ≥ωΓςH1=49.44kJΓΛmolΘ≠1 -(-41.20 kJ/mol)= +90.64 kJ/molΘ§Ι ¥πΑΗΈΣΘΚ90.64ΘΜ
CO2(g)+3H2(g) ΓςH3ΘΫ+49.44kJΓΛmolΘ≠1ΔέΘ§ΗυΨίΗ«ΥΙΕ®¬…ΔΌ=Δέ-ΔΎΘ§Φ¥Ω…«σ≥ωΓςH1=49.44kJΓΛmolΘ≠1 -(-41.20 kJ/mol)= +90.64 kJ/molΘ§Ι ¥πΑΗΈΣΘΚ90.64ΘΜ
(2)ΜνΜ·ΡήΈΣΖ¥”ΠΈοΒΡΉήΡήΝΩ”κΙΐΕ…Χ§ΡήΝΩ÷°≤νΘ§¥”ΆΦ÷–Ω…“‘Ω¥≥ωΘ§ΙΐΕ…Χ§3ΖΔ…ζΒΡΖ¥”ΠΜνΜ·ΡήΉν–ΓΘ§Ζ¥”ΠΈοΈΣCH2O*+2H*Θ§≤ζΈοΈΣCHO*+3HΘ§Ι Ζ¥”ΠΖΫ≥Χ ΫΈΣCH2O*+2H*=CHO*+3H*ΓΘ“ρΈΣ2H*Ζ¥”Π«ΑΚσΕΦΈϋΗΫ‘Ύ¥ΏΜ·ΦΝ±μΟφΘ§Έ¥≤Έ”κΖ¥”ΠΘ§Ι Ζ¥”Π Β÷ ΈΣCH2O*=CHO*+H*Θ§Ι ¥πΑΗΈΣΘΚCH2O*+2H*=CHO*+3H* (ΜρCH2O*=CHO*+H*)ΘΜ
(3)ΔΌ“ρΈΣΈ¬Ε»…ΐΗΏΘ§Ζ¥”ΠΥΌ¬ ”ΠΦ”ΩλΘ§ΕχΆΦ÷–ΥΌ¬ Φθ–ΓΘ§œ‘»Μ≤Μ «Έ¬Ε»ΒΡ”ΑœλΘ§÷ΜΡήΈΣ¥ΏΜ·ΦΝΒΡΜν–‘ΫΒΒΆΘ§Ι ¥πΑΗΈΣΘΚΥφΈ¬Ε»…ΐΗΏΘ§¥ΏΜ·Μν–‘ΫΒΒΆΘΜ
ΔΎΕ‘”ΎΖ¥”ΠCO(g)+H2O(g) ![]() CO2(g)+H2(g) ΓςHΘΦ0Θ§ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβœρΉσ“ΤΕ·Θ§Φ¥COΓΔH2OΒΡΚ§ΝΩΨυ‘ω¥σΘ§CO2ΓΔH2ΒΡΚ§ΝΩΨυΦθ–ΓΓΘ“άΨίΆΦ÷––≈œΔΘ§Ω…≥θ≤ΫΒΟ÷ΣΘ§aΓΔb«ζœΏΖ÷±πΕ‘”ΠCO2ΜρH2Θ§cΓΔd«ζœΏ‘ρΕ‘”ΠCOΜρH2O(g)ΓΘΗυΨίΖ¥”ΠΖΫ≥Χ ΫΩ…÷ΣΘΚΗΟΖ¥”ΠΤπ Φ ±Θ§n(H2)ΘΨn(CO2)ΓΔn(H2O)ΘΨn(CO)Θ§ΤΫΚβ ±Κ§ΝΩ±Ί»Μ”–n(H2)ΘΨn(CO2)ΓΔn(H2O)ΘΨn(CO)Θ§Ι aΓΔbΓΔcΓΔd«ζœΏΖ÷±πΕ‘”ΠH2ΓΔCO2ΓΔH2O(g)ΓΔCOΘ§aΒΡΚ§ΝΩ‘Φ «cΒΡΚ§ΝΩ3±ΕΘ§ΥΒΟςΖ¥”ΠΑ¥CH3OHΘΪH2O
CO2(g)+H2(g) ΓςHΘΦ0Θ§ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβœρΉσ“ΤΕ·Θ§Φ¥COΓΔH2OΒΡΚ§ΝΩΨυ‘ω¥σΘ§CO2ΓΔH2ΒΡΚ§ΝΩΨυΦθ–ΓΓΘ“άΨίΆΦ÷––≈œΔΘ§Ω…≥θ≤ΫΒΟ÷ΣΘ§aΓΔb«ζœΏΖ÷±πΕ‘”ΠCO2ΜρH2Θ§cΓΔd«ζœΏ‘ρΕ‘”ΠCOΜρH2O(g)ΓΘΗυΨίΖ¥”ΠΖΫ≥Χ ΫΩ…÷ΣΘΚΗΟΖ¥”ΠΤπ Φ ±Θ§n(H2)ΘΨn(CO2)ΓΔn(H2O)ΘΨn(CO)Θ§ΤΫΚβ ±Κ§ΝΩ±Ί»Μ”–n(H2)ΘΨn(CO2)ΓΔn(H2O)ΘΨn(CO)Θ§Ι aΓΔbΓΔcΓΔd«ζœΏΖ÷±πΕ‘”ΠH2ΓΔCO2ΓΔH2O(g)ΓΔCOΘ§aΒΡΚ§ΝΩ‘Φ «cΒΡΚ§ΝΩ3±ΕΘ§ΥΒΟςΖ¥”ΠΑ¥CH3OHΘΪH2O![]() CO2ΘΪ3H2Ϋχ––Θ§Ι ¥πΑΗΈΣΘΚa ΈΣ«βΤχΘ§c ΈΣCO2Θ§Εΰ’Ώ «Ά®ΙΐΖ¥”ΠCH3OHΘΪH2O
CO2ΘΪ3H2Ϋχ––Θ§Ι ¥πΑΗΈΣΘΚa ΈΣ«βΤχΘ§c ΈΣCO2Θ§Εΰ’Ώ «Ά®ΙΐΖ¥”ΠCH3OHΘΪH2O ![]() CO2ΘΪ3H2 …ζ≥…Θ§«βΤχΒΡΚ§ΝΩ «Εΰ―θΜ·ΧΦΒΡ3±ΕΘΜ
CO2ΘΪ3H2 …ζ≥…Θ§«βΤχΒΡΚ§ΝΩ «Εΰ―θΜ·ΧΦΒΡ3±ΕΘΜ
(4)ΗυΨίΖ¥”ΠCH3OH(g)![]() CO(g)ΘΪ2H2(g)ΔΌ≤…”Ο“Μ±ΏΒΙΘ§ΔρΩ…“‘ΉΣΜ·ΈΣ8mol COΚΆ12molH2Θ§ΔώΒΡΧεΜΐΈΣΔρΒΡ“ΜΑκΘ§ΤΫΚβΉ¥Χ§“Μ―υΘ§‘ρa=12mol/2=6molΘ§Ι ¥πΑΗΈΣ6ΘΜ
CO(g)ΘΪ2H2(g)ΔΌ≤…”Ο“Μ±ΏΒΙΘ§ΔρΩ…“‘ΉΣΜ·ΈΣ8mol COΚΆ12molH2Θ§ΔώΒΡΧεΜΐΈΣΔρΒΡ“ΜΑκΘ§ΤΫΚβΉ¥Χ§“Μ―υΘ§‘ρa=12mol/2=6molΘ§Ι ¥πΑΗΈΣ6ΘΜ
ΔΎΈ¬Ε»œύΆ§Θ§‘ρΔώΓΔΔρΒΡKœύΒ»Θ§ΗυΨίΔρΦΤΥψΘ§ΤΫΚβ ±c(H2)=0.5mol/LΘ§n(H2)=4molΘ§ΗυΨί»ΐΕΈ ΫΘ§

Ω…÷ΣΔρ¥Π”ΎΤΫΚβΉ¥Χ§Θ§ΤΫΚβ ±c(H2)=0.5mol/LΘ§c(CO)=0.5mol/LΘ§c(CH3OH)=0.5mol/LΘ§K=![]() Θ§Ι ¥πΑΗΈΣ0.25ΘΜ
Θ§Ι ¥πΑΗΈΣ0.25ΘΜ
Δέ”……œΈ Ω…÷ΣΘ§Δρ÷–Α¥±μΗώ ΐΨί≥δ»κΖ¥”ΠΚσΘ§¥Υ ±Ζ¥”ΠΒΡΖΫœρ≤Μ±δΘ§Ι ¥πΑΗΈΣΘΚΤΫΚβΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΙΊ”ΎΉ‘»ΜΫγ÷–ΒΣ―≠ΜΖΘ®»γΆΦΘ©ΒΡΥΒΖ®≤Μ’ΐ»ΖΒΡ «ΘΚ

A. ΒΣ‘ΣΥΊΨυ±Μ―θΜ·
B. ΙΛ“ΒΚœ≥…Α± τ”Ύ»ΥΙΛΙΧΒΣ
C. Κ§ΒΣΈόΜζΈοΚΆΚ§ΒΣ”–ΜζΈοΩ…œύΜΞΉΣΜ·
D. ΧΦΓΔ«βΓΔ―θ»ΐ÷÷‘ΣΥΊ“≤≤Έ”κΝΥΒΣ―≠ΜΖ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§ΦΉΥαΚΆ““ΥαΒΡΒγάκ≥Θ ΐΖ÷±πΈΣ1.8ΓΝ10-4ΚΆ1.8ΓΝ10-5ΓΘΫΪpHΚΆΧεΜΐΨυœύΆ§ΒΡΝΫ÷÷Υα»ή“ΚΖ÷±πœΓ ΆΘ§ΤδpHΥφΦ”Υ°ΧεΜΐΒΡ±δΜ·»γΆΦΥυ ΨΓΘΝΫ÷÷Υα”ΟΆ® ΫHY±μ ΨΘ§œ¬Ν––π ω’ΐ»ΖΒΡ «
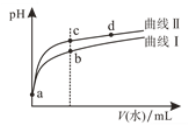
A.«ζœΏΔρ¥ζ±μ““Υα
B.ΥαΒΡΒγάκ≥ΧΕ»ΘΚcΒψΘΨdΒψ
C.»ή“Κ÷–Υ°ΒΡΒγάκ≥ΧΕ»ΘΚbΒψΘΨcΒψ
D.¥”cΒψΒΫdΒψΘ§»ή“Κ÷–![]() ±Θ≥÷≤Μ±δ
±Θ≥÷≤Μ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»Φ…’0.1 molΡ≥”–ΜζΈοΒΟ0.2 mol CO2ΚΆ0.3 mol H2OΘ§”…¥ΥΒΟ≥ωΒΡΫα¬έ≤Μ’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. ΗΟ”–ΜζΈοΖ÷Ή”ΒΡΫαΙΙΦρ ΫΈΣCH3ΓΣCH3
B. ΗΟ”–ΜζΈο÷–ΧΦΓΔ«β‘ΣΥΊ‘≠Ή” ΐΡΩ÷°±»ΈΣ1ΓΟ3
C. ΗΟ”–ΜζΈοΖ÷Ή”÷–≤ΜΩ…ΡήΚ§”–![]() ΥΪΦϋ
ΥΪΦϋ
D. ΗΟ”–ΜζΈοΖ÷Ή”÷–Ω…ΡήΚ§”–―θ‘≠Ή”
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΡ≥÷÷”–ΜζΈοAΒΡ÷ ΤΉΆΦΚΆΚλΆβΙβΤΉΆΦ»γΆΦΘ§“‘œ¬ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
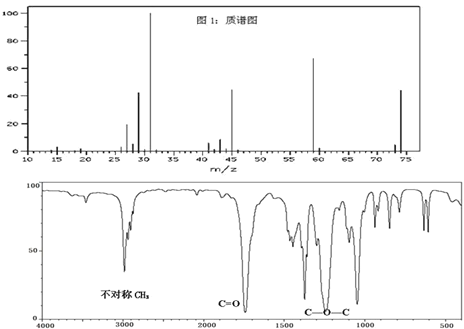
A.”…÷ ΤΉΆΦΩ…÷ΣΘ§”–ΜζΈοAΒΡΡΠΕϊ÷ ΝΩΈΣ74
B.”…ΚλΆβΙβΤΉΩ…÷ΣΘ§”–ΜζΈοAΒΡΖ÷Ή” ΫC3H6O2
C.”–ΜζΈοAΒΡΚΥ¥≈Ι≤’ώ«βΤΉΆΦ÷–”–3÷÷Έϋ ’ΖεΘ§ΖεΟφΜΐ÷°±»ΈΣ1ΘΚ2ΘΚ3
D.”–ΜζΈοAΒΡΟϊ≥ΤΈΣΦΉΥα““θΞΘ§ΙΌΡήΆ≈ΈΣθΞΜυ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎCF3COOHΥ°»ή“Κ÷–ΫΪΦΉΆι÷±Ϋ”ΉΣΜ·ΈΣCF3COOCH3Θ®Υ°Ϋβ…ζ≥…CH3OHΘ©ΒΡΖ¥”ΠΜζάμ»γΆΦΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
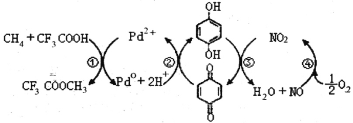
A.ΥυΚ§≤ΩΖ÷‘ΣΥΊΒΎ“ΜΒγάκΡήΘΚC<N<O<F
B.Ζ¥”ΠΔέΒΡ―θΜ·ΦΝΈΣΕ‘±ΫΕΰΖ”
C.…œ ωΖ¥”ΠΒΡΉήΖ¥”Π ΫΈΣΘΚCH4+CF3COOH+![]() O2
O2 CF3COOCH3+H2O
CF3COOCH3+H2O
D. ΨυΩ…“‘”κ≈®δεΥ°Ζ¥”ΠΘ§«“Ζ¥”Πάύ–ΆœύΆ§
ΨυΩ…“‘”κ≈®δεΥ°Ζ¥”ΠΘ§«“Ζ¥”Πάύ–ΆœύΆ§
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»βΙπΝρΑΖΘ®CinanserinΘ© «…œ άΦΆ70Ρξ¥ζ”Ο”ΎΩΙΨΪ…ώΖ÷Ν―÷ΔΒΡ“©ΈοΘ§Ε‘ΙΎΉ¥≤ΓΕΨ3CLΥ°ΫβΟΗΨΏ”–“÷÷ΤΉς”ΟΘ§œ¬ΆΦ «ΤδΚœ≥…¬ΖœΏΆΦΓΘ

“―÷Σ“‘œ¬–≈œΔΘΚ
ΔΌAΈΣ≥ΘΦϊΒΡΧΰΘ§ΥϋΕ‘H2ΒΡœύΕ‘ΟήΕ»ΈΣ39
ΔΎ2RCOOH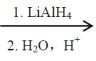 RCH2OH
RCH2OH
Δέ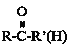 +HCN
+HCN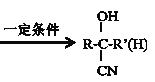
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©AΒΡΟϊ≥Τ__________ΘΜBΒΡΫαΙΙΦρ Ϋ___________ΘΜ»βΙπΝρΑΖ÷–Κ§―θΙΌΡήΆ≈ΒΡΟϊ≥Τ__________ΓΘ
Θ®2Θ©≤Ϋ÷ηΔΌΒΡΖ¥”ΠΖΫ≥Χ Ϋ________________Θ§ΤδΖ¥”Πάύ–ΆΈΣ_________ΓΘ
Θ®3Θ©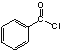 ÷–Ι≤ΤΫΟφΒΡ‘≠Ή”ΉνΕύ________ΗωΓΘ
÷–Ι≤ΤΫΟφΒΡ‘≠Ή”ΉνΕύ________ΗωΓΘ
Θ®4Θ©M «CΒΡΆ§Ζ÷“λΙΙΧεΘ§ΖϊΚœœ¬Ν–ΧθΦΰΒΡM”–_______÷÷ΓΘ
ΔΌ τ”ΎΖΦœψΉεΜ·ΚœΈοΓΘΔΎΡήΖΔ…ζ“χΨΒΖ¥”ΠΓΘ
Θ®5Θ©≤Έ’’ΧβΗ…Θ§–¥≥ω”…![]() ÷Τ±Η
÷Τ±Η![]() ΒΡΝς≥ΧΆΦΓΘ_______ΓΘ
ΒΡΝς≥ΧΆΦΓΘ_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΝρ¥ζΝρΥαΡΤ(Na2S2O3) «“Μ÷÷ΫβΕΨ“©Θ§”Ο”ΎΖζΜ·ΈοΓΔ…ιΓΔΙ·ΓΔ«ΠΓΔΈΐΓΔΒβΒ»÷–ΕΨΘ§ΝΌ¥≤≥Θ”Ο”Ύ÷ΈΝΤίΓ¬ι’νΘ§ΤΛΖτπΰ―ςΒ»≤Γ÷Δ.Νρ¥ζΝρΥαΡΤ‘Ύ÷––‘ΜρΦν–‘ΜΖΨ≥÷–Έ»Ε®Θ§‘ΎΥα–‘»ή“Κ÷–Ζ÷Ϋβ≤ζ…ζSΚΆSO2
Β―ιIΘΚNa2S2O3ΒΡ÷Τ±ΗΓΘΙΛ“Β…œΩ…”ΟΖ¥”ΠΘΚ2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2÷ΤΒΟΘ§ Β―ι “ΡΘΡβΗΟΙΛ“ΒΙΐ≥ΧΒΡΉΑ÷Ο»γΆΦΥυ ΨΘΚ

(1)“«ΤςaΒΡΟϊ≥Τ «_______Θ§“«ΤςbΒΡΟϊ≥Τ «_______ΓΘb÷–άϊ”Ο÷ ΝΩΖ÷ ΐΈΣ70%80%ΒΡH2SO4»ή“Κ”κNa2SO3ΙΧΧεΖ¥”Π÷Τ±ΗSO2Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______ΓΘc÷– ‘ΦΝΈΣ_______
(2) Β―ι÷–“ΣΩΊ÷ΤSO2ΒΡ…ζ≥…ΥΌ¬ Θ§Ω…“‘≤…»ΓΒΡ¥κ ©”–_______ (–¥≥ω“ΜΧθ)
(3)ΈΣΝΥ±Θ÷ΛΝρ¥ζΝρΥαΡΤΒΡ≤ζΝΩΘ§ Β―ι÷–Ά®»κΒΡSO2≤ΜΡήΙΐΝΩΘ§‘≠“ρ «_______
Β―ιΔρΘΚΧΫΨΩNa2S2O3”κΫπ τ―τάκΉ”ΒΡ―θΜ·ΜΙ‘≠Ζ¥”ΠΓΘ
Ή ΝœΘΚFe3++3S2O32-Fe(S2O3)33-(ΉœΚΎ…Ϊ)
ΉΑ÷Ο | ‘ΦΝX | Β―ιœ÷œσ |
| Fe2(SO4)3»ή“Κ | ΜλΚœΚσ»ή“Κœ»±δ≥…ΉœΚΎ…ΪΘ§30sΚσΦΗΚθ±δΈΣΈό…Ϊ |
(4)ΗυΨί…œ ω Β―ιœ÷œσΘ§≥θ≤Ϋ≈–ΕœΉν÷’Fe3+±ΜS2O32-ΜΙ‘≠ΈΣFe2+Θ§Ά®Ιΐ_______(Χν≤ΌΉςΓΔ ‘ΦΝΚΆœ÷œσ)Θ§Ϋχ“Μ≤Ϋ÷Λ Β…ζ≥…ΝΥFe2+ΓΘ¥”Μ·―ßΖ¥”ΠΥΌ¬ ΚΆΤΫΚβΒΡΫ«Ε»Ϋβ Ά Β―ιΔρΒΡœ÷œσΘΚ_______
Β―ιΔσΘΚ±ξΕ®Na2S2O3»ή“ΚΒΡ≈®Ε»
(5)≥Τ»Γ“ΜΕ®÷ ΝΩΒΡ≤ζΤΖ≈δ÷Τ≥…Νρ¥ζΝρΥαΡΤ»ή“ΚΘ§≤Δ”ΟΦδΫ”ΒβΝΩΖ®±ξΕ®ΗΟ»ή“ΚΒΡ≈®Ε»ΘΚ”ΟΖ÷ΈωΧλΤΫΉΦ»Ζ≥Τ»ΓΜυΉΦΈο÷ K2Cr2O7(ΡΠΕϊ÷ ΝΩΈΣ294gmol-1)0.5880gΓΘΤΫΨυΖ÷≥…3ΖίΘ§Ζ÷±πΖ≈»κ3ΗωΉΕ–ΈΤΩ÷–Θ§Φ”Υ°≈δ≥…»ή“ΚΘ§≤ΔΦ”»κΙΐΝΩΒΡKI≤ΔΥαΜ·Θ§ΖΔ…ζœ¬Ν–Ζ¥”ΠΘΚ6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2OΘ§‘ΌΦ”»κΦΗΒΈΒμΖέ»ή“ΚΘ§ΝΔΦ¥”ΟΥυ≈δNa2S2O3»ή“ΚΒΈΕ®Θ§ΖΔ…ζΖ¥”ΠI2+2S2O32- = 2I- + S4O62-Θ§»ΐ¥ΈœϊΚΡ Na2S2O3»ή“ΚΒΡΤΫΨυΧεΜΐΈΣ25.00 mLΘ§‘ρΥυ±ξΕ®ΒΡΝρ¥ζΝρΥαΡΤ»ή“ΚΒΡ≈®Ε»ΈΣ_______molL-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®1Θ©‘Ύ“ΜΕ®Έ¬Ε»œ¬Θ§”–œ¬Ν–Ζ¥”ΠΖΔ…ζΘΚFe2O3(s)ΘΪ3CO(g) 2Fe(s)ΘΪ3CO2(g)Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫKΘΫ________ΓΘ
Θ®2Θ©‘Ύ≈δ÷ΤFeCl3»ή“Κ ±Θ§Φ”»κ…Ό–μ≈®―ΈΥαΘ§ΤδΡΩΒΡ «ΘΚ_____________ΘΜ≤ΜΕœΦ”»»FeCl3»ή“ΚΘ§’τΗ…ΤδΥ°Ζ÷≤ΔΉΤ…’ΙΧΧεΘ§ΉνΚσΒΟΒΫΒΡΈο÷ «________ΓΘ
Θ®3Θ©“―÷ΣΘΚFe2O3(s)ΘΪ![]() C(s)=
C(s)=![]() CO2(g)ΘΪ2Fe(s) ΠΛHΘΫΘΪ234.1 kJ/mol
CO2(g)ΘΪ2Fe(s) ΠΛHΘΫΘΪ234.1 kJ/mol
C(s)ΘΪO2(g)===CO2(g)ΓΓ ΠΛHΘΫΘ≠393.5 kJ/mol
‘ρ2Fe(s)ΘΪ![]() O2(g)===Fe2O3(s)ΒΡΠΛH «____________________ΓΘ
O2(g)===Fe2O3(s)ΒΡΠΛH «____________________ΓΘ
Θ®4Θ©Fe(OH)2‘ΎΩ’Τχ÷–ΕΧ ±ΦδΡΎΩ…±Μ―θΜ·ΈΣFe(OH)3Θ§ΖΔ…ζΒΡΖ¥”ΠΈΣΘΚ4Fe(OH)2ΘΪO2ΘΪ2H2O=4Fe(OH)3Θ§œ¬Ν–ΥΒΖ®÷–¥μΈσΒΡ «________(ΧνΉ÷ΡΗ)ΓΘ
AΘ°ΗΟΖ¥”Π «ΡήΉ‘ΖΔΫχ––ΒΡΖ¥”Π
BΘ°ΗΟΖ¥”Π «λΊ‘ωΦ”ΒΡΖ¥”Π
CΘ°ΗΟΖ¥”Π «Μ·ΚœΖ¥”Π
DΘ°ΗΟΖ¥”Π «―θΜ·ΜΙ‘≠Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com