
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
【答案】分液漏斗 蒸馏烧瓶 ![]() 硫化钠和碳酸钠的混合液 调节酸的滴加速度 若 SO2过量,溶液显酸性.产物会发生分解 加入铁氰化钾溶液.产生蓝色沉淀 开始生成 Fe(S2O3)33-的反应速率快,氧化还原反应速率慢,但Fe3+与S2O32- 氧化还原反应的程度大,导致Fe3++3S2O32-Fe(S2O3)33-(紫黑色)平衡向逆反应方向移动,最终溶液几乎变为无色 0.1600
硫化钠和碳酸钠的混合液 调节酸的滴加速度 若 SO2过量,溶液显酸性.产物会发生分解 加入铁氰化钾溶液.产生蓝色沉淀 开始生成 Fe(S2O3)33-的反应速率快,氧化还原反应速率慢,但Fe3+与S2O32- 氧化还原反应的程度大,导致Fe3++3S2O32-Fe(S2O3)33-(紫黑色)平衡向逆反应方向移动,最终溶液几乎变为无色 0.1600
【解析】
(1)a的名称即为分液漏斗,b的名称即为蒸馏烧瓶;b中是通过浓硫酸和Na2SO3反应生成SO2,所以方程式为:![]() ;c中是制备硫代硫酸钠的反应,SO2由装置b提供,所以c中试剂为硫化钠和碳酸钠的混合溶液;
;c中是制备硫代硫酸钠的反应,SO2由装置b提供,所以c中试剂为硫化钠和碳酸钠的混合溶液;
(2)从反应速率影响因素分析,控制SO2生成速率可以调节酸的滴加速度或者调节酸的浓度,或者改变反应温度;
(3)题干中指出,硫代硫酸钠在酸性溶液中会分解,如果通过量的SO2,会使溶液酸性增强,对制备产物不利,所以原因是:SO2过量,溶液显酸性,产物会发生分解;
(4)检验Fe2+常用试剂是铁氰化钾,所以加入铁氰化钾溶液,产生蓝色沉淀即证明有Fe2+生成;解释原因时一定要注意题干要求,体现出反应速率和平衡两个角度,所以解释为:开始阶段,生成![]() 的反应速率快,氧化还原反应速率慢,所以有紫黑色出现,随着Fe3+的量逐渐增加,氧化还原反应的程度变大,导致平衡逆向移动,紫黑色逐渐消失,最终溶液几乎变为无色;
的反应速率快,氧化还原反应速率慢,所以有紫黑色出现,随着Fe3+的量逐渐增加,氧化还原反应的程度变大,导致平衡逆向移动,紫黑色逐渐消失,最终溶液几乎变为无色;
(5)间接碘量法滴定过程中涉及两个反应:①![]() ;②
;②![]() ;反应①I-被氧化成I2,反应②中第一步所得的I2又被还原成I-,所以①与②电子转移数相同,那么滴定过程中消耗的
;反应①I-被氧化成I2,反应②中第一步所得的I2又被还原成I-,所以①与②电子转移数相同,那么滴定过程中消耗的![]() 得电子总数就与消耗的
得电子总数就与消耗的![]() 失电子总数相同 ;在做计算时,不要忽略取的基准物质重铬酸钾分成了三份进行的滴定。所以假设c(Na2S2O3)=a mol/L,列电子得失守恒式:
失电子总数相同 ;在做计算时,不要忽略取的基准物质重铬酸钾分成了三份进行的滴定。所以假设c(Na2S2O3)=a mol/L,列电子得失守恒式:![]() ,解得a=0.1600mol/L。
,解得a=0.1600mol/L。


科目:高中化学 来源: 题型:
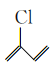
【题目】某有机物的结构简式为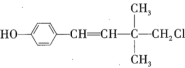 ,下列关于该有机物的说法错误的是( )
,下列关于该有机物的说法错误的是( )
A.有顺反异构B.可以和浓溴水发生取代反应和加成反应
C.可以发生加聚反应、水解反应和消去反应D.1mol该有机物最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知:甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)
CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
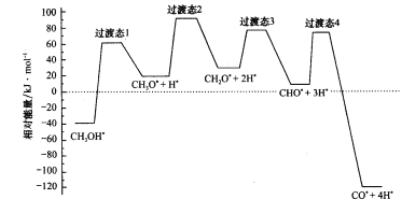
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为_________________________。
(3)在0.1MPa下,将总进料量1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是__________。
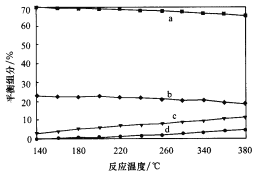
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,试解释a的含量约是c的含量3倍的原因__________。
(4)297 K时,向密闭容器Ⅰ(体积为4L)和Ⅱ(体积为8L)中分别充入下列物质发生反应,
编号 | CO(mol) | H2(mol) | CH3OH(mol) |
Ⅰ | 4 | a | 0 |
Ⅱ | 4 | 4 | 4 |
达平衡时两个容器中c(H2)相等且c(H2)=0.5mol/L。则
①a=_____________。
②该温度时,Ⅰ中反应的K=___________。
③Ⅱ中按表格数据充入反应物此时反应的方向__________(填“正向进行”、“平衡”或“逆向进行”)。
查看答案和解析>>
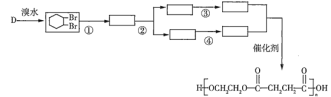
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
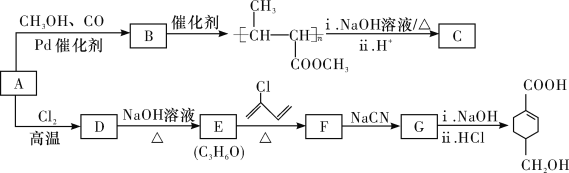
已知:
①![]() +
+![]()
![]()
![]()
②R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)D的名称是___________,B含有的含氧官能团的名称是__________。
(2)C的结构简式为_____________,D→E的反应类型为 ____________。
(3)E→F的化学方程式为___________。
(4) 中最多有_____个原子共平面,
中最多有_____个原子共平面,![]() 发生缩聚反应生成有机物的结构简式为__________。
发生缩聚反应生成有机物的结构简式为__________。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有_______种(不考虑立体异构);其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为 _______(MnO4-被还原为Mn2+)
(2)甲烷硫磺法制取CS2的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H。
CS2(g)+2H2S(g) △H。
① 在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_______(填字母)
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H—S键数目相等
②已知下列键能数据:
共价键 | C—H | S=S | C=S | H—S |
律能/kJmol-1 | 411 | 425 | 573 | 363 |
该反应的△H _______kJmol-1
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g) +2H2S(g)CS2(g) + 4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
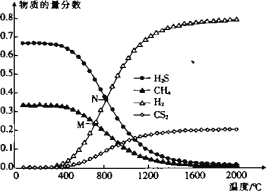
①该反应△H _______(填“>”或“<”)0。
②M点,H2S的平衡转化率为_______,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是_______(列举一条)。
③N点,平衡分压p(CS2)=_______MPa,对应温度下,该反应的KP =_______(MPa)2。(KP为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
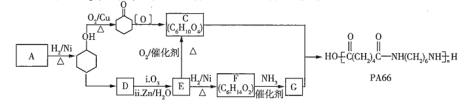
【题目】高分子化合物![]() 的合成路线如下:
的合成路线如下:
已知: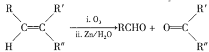 。
。
(1)![]() 的相对分子质量为94,属于芳香化合物,其结构简式是____________。
的相对分子质量为94,属于芳香化合物,其结构简式是____________。
(2)![]() 的反应条件是__________;
的反应条件是__________;![]() 的化学方程式是__________________。
的化学方程式是__________________。
(3)![]() 中所含官能团的名称是_______________。
中所含官能团的名称是_______________。
(4)![]() 有多种同分异构体,写出符合下列条件的一种同分异构体的结构简式:_______________。
有多种同分异构体,写出符合下列条件的一种同分异构体的结构简式:_______________。
i.属于醇类 ii.所有碳原子之间均以单键相连
(5)只用有机物![]() 可合成聚丁二酸乙二酯,请结合题中信息补充完整下列合成路线__________(方框中用结构简式表示有机物,用箭头表示转化关系,在箭头上注明试剂和反应条件)。
可合成聚丁二酸乙二酯,请结合题中信息补充完整下列合成路线__________(方框中用结构简式表示有机物,用箭头表示转化关系,在箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___;基态As原子的核外电子排布式为___。
(2)NH3的沸点比PH3的___(填“高”或低”),原因是___。
(3)Na3AsO4中含有的化学键类型包括___,AsO43-的空间构型为___。
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___,该晶胞的密度为___g·cm-3(用含NA、a的式子表示)。
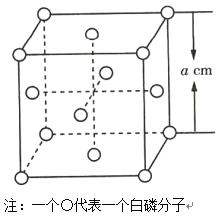
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可以证明一水合氨是弱电解质的是
①室温下,![]() 的氨水可以使酚酞试液变红②室温下,
的氨水可以使酚酞试液变红②室温下,![]() 的氯化铵溶液的PH约为5
的氯化铵溶液的PH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱④铵盐受热易分解
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
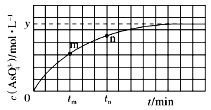
A. 溶液的pH不再变化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再变化
D. c(I-)=2ymol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com