
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___;基态As原子的核外电子排布式为___。
(2)NH3的沸点比PH3的___(填“高”或低”),原因是___。
(3)Na3AsO4中含有的化学键类型包括___,AsO43-的空间构型为___。
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___,该晶胞的密度为___g·cm-3(用含NA、a的式子表示)。
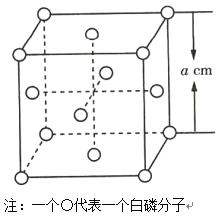
【答案】N>P>As 1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 高 NH3和PH3均为分子晶体,但NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力 离子键、共价键 正四面体形 16 ![]()
【解析】
(1)同主族元素从上到下第一电离能减小,所以N、P、As的第一电离能由大到小的顺序为N>P>As;根据能量最低原则,基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:N>P>As;1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力,所以NH3的沸点比PH3的高,
故答案为:高;NH3和PH3均为分子晶体,但NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力;
(3)Na3AsO4是离子化合物,含有离子键,![]() 中As与O之间是共价键,所以Na3AsO4中含有的化学键类型包括离子键、共价键;
中As与O之间是共价键,所以Na3AsO4中含有的化学键类型包括离子键、共价键;![]() 的价电子对数
的价电子对数![]() ,无孤电子对,所以
,无孤电子对,所以![]() 的空间构型为正四面体形,
的空间构型为正四面体形,
故答案为:离子键、共价键;正四面体形;
(4)根据晶胞结构可知一个晶胞中P原子数![]() ;该晶胞的摩尔质量是16×31g/mol=496g/mol,该晶胞的体积是a3cm3,该晶胞的密度为
;该晶胞的摩尔质量是16×31g/mol=496g/mol,该晶胞的体积是a3cm3,该晶胞的密度为![]() ,
,
故答案为:16;![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,甲酸和乙酸的电离常数分别为1.8×10-4和1.8×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。两种酸用通式HY表示,下列叙述正确的是
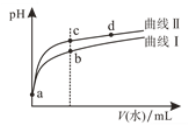
A.曲线Ⅱ代表乙酸
B.酸的电离程度:c点>d点
C.溶液中水的电离程度:b点>c点
D.从c点到d点,溶液中![]() 保持不变
保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂硫胺(Cinanserin)是上世纪70年代用于抗精神分裂症的药物,对冠状病毒3CL水解酶具有抑制作用,下图是其合成路线图。

已知以下信息:
①A为常见的烃,它对H2的相对密度为39
②2RCOOH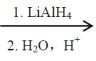 RCH2OH
RCH2OH
③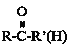 +HCN
+HCN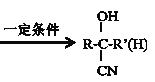
回答下列问题:
(1)A的名称__________;B的结构简式___________;肉桂硫胺中含氧官能团的名称__________。
(2)步骤①的反应方程式________________,其反应类型为_________。
(3) 中共平面的原子最多________个。
中共平面的原子最多________个。
(4)M是C的同分异构体,符合下列条件的M有_______种。
①属于芳香族化合物。②能发生银镜反应。
(5)参照题干,写出由![]() 制备
制备![]() 的流程图。_______。
的流程图。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫(SF6)分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是( )
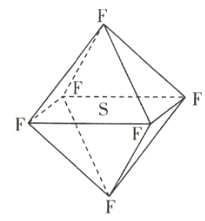
A.SF6各原子均达到最外层8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.SF6是原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)(CH3)3 NH+和![]() 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作___________(填序号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作___________(填序号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
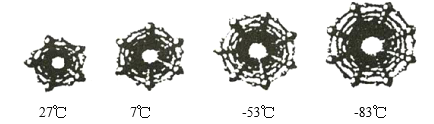
(2)为了研究在纳米级的空间中水的结冰温度,科学家对不同直径碳纳米管中水的结冰温度进行分析。如图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,可广泛用作防护材料。该高分子化合物的结构片段如图所示。下列说法正确的是( )
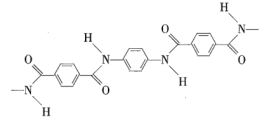
A.羊毛与芳纶纤维的主要化学成分相同
B.该高分子化合物的结构简式为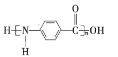
C.该高分子化合物完全水解产生的单个分子中,每个分子苯环上的氢原子都具有不同的化学环境
D.通过质谱法测定芳纶纤维的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:_____________;不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+![]() O2(g)===Fe2O3(s)的ΔH是____________________。
O2(g)===Fe2O3(s)的ΔH是____________________。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是( )
A.![]() +H2O
+H2O![]()
![]() +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2O![]() Al(OH)3(胶体)+3H+ 明矾净水
Al(OH)3(胶体)+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl制备TiO2纳米粉
TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com