
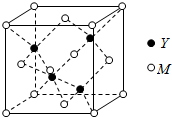
 M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:分析 依据题意可知:M为铜元素,Y为氯元素;
(1)铜属于金属,金属阳离子与电子之间通过金属键结合在一起,晶体类型为金属晶体;铜晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法确定其配位数;
(2)元素氯是17号元素,位于第三周期,依据构造原理排布排布基态电子;稀有气体的第一电离能最大;含氯的酸中高氯酸酸性最强是含氧酸中最强酸;依据酸根离子中氯原子为sP3杂化方式判断其构型;
(3)①依据晶胞结构,利用切割法分析,每个晶胞中含有铜原子个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氯原子个数为4,则化学式为;CuCl;1mol晶胞中含有4molCuCl,1mol晶胞的质量为M(CuCl)×4,晶胞参数a=0.542nm,则晶体密度为$\frac{4×M(CuCl)}{{N}_{A}×{a}^{3}×1{0}^{21}}$,据此解答;
②Cu+可与氨形成易溶于水的配位化合物,所以CuCl难溶于水但易溶于氨水;该化合物中Cu+被氧化为Cu2+,所以深蓝色溶液中阳离子为:[Cu(NH3)4]2+;
解答 解:(1)铜属于金属,金属阳离子与电子之间通过金属键结合在一起,晶体类型为金属晶体,铜晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法知,每个平面上铜原子的配位数是4,三个面共有4×3=12个铜原子,所以每个铜原子的配位数是12;
故答案为:金属晶体;金属键;12;
(2)元素氯是17号元素,位于第三周期,依据构造原理其基态电子排布为:1s22s22p63s23p5;其同周期元素中,第一电离能最大的是Ar,含氯的酸中高氯酸酸性最强是含氧酸中最强酸,化学式为:HClO4,高氯酸酸根离子中氯原子为sP3杂化,没有孤对电子数,立体构型为正四面体;
故答案为:1s22s22p63s23p5;Ar; HClO4; 正四面体;
(3)①依据晶胞结构,利用切割法分析,每个晶胞中含有铜原子个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氯原子个数为4,则化学式为;CuCl;1mol晶胞中含有4molCuCl,1mol晶胞的质量为M(CuCl)×4,晶胞参数a=0.542nm,则晶体密度为;$\frac{4M(CuCl)}{{N}_{A}×{a}^{3}×1{0}^{-21}}$;
故答案为:CuCl;$\frac{4M(CuCl)}{{N}_{A}×{a}^{3}×1{0}^{-21}}$;
②Cu+可与氨形成易溶于水的配位化合物,所以CuCl难溶于水但易溶于氨水;该化合物中Cu+被氧化为Cu2+,所以深蓝色溶液中阳离子为:[Cu(NH3)4]2+;
故答案为:Cu+可与氨形成易溶于水的配位化合物(或配离子);[Cu(NH3)4]2+.
点评 本题考查了晶体类型及结构特点,涉及到电子排布式、第一电离能、杂化类型的判断、配合物以及有关晶体的计算,题目难度较大,解题时注意切割法分析晶胞的技巧.


科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| B. | 在常温常压下,1摩氦气含有的原子数为2NA | |
| C. | 在常温常压下,32克氧气所含原子数目为2NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
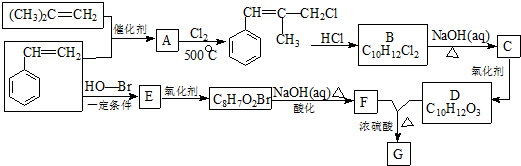
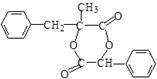 .
.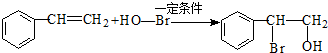 .
.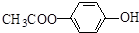 和
和 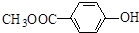 .
.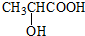 ) 的合成线路
) 的合成线路 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为2.408×1023个 | |
| C. | 可生成H2的体积为0.224L(标准情况) | |
| D. | 生成H2的量理论上等于0.04mol Na与水反应产生H2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火 | |
| B. | 用石英制成光导纤维,由水玻璃制硅胶都是化学变化 | |
| C. | 火法炼铜、湿法炼铜都是置换反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氢化物的沸点比R的氢化物的沸点高 | |
| B. | Z、W、R按最高价氧化物对应水化物的酸性强弱排列顺序是R>W>Z | |
| C. | X2Y2化合物中的化学键与X2R中的化学键类型完全相同 | |
| D. | RY2通入Ba(NO3)2溶液中有白色沉淀生成,该沉淀不溶于硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com