
(1)沉淀的化学式:_________________________________________________。
(2)生成沉淀的化学方程式:_______________________________________________。
科目:高中化学 来源: 题型:阅读理解
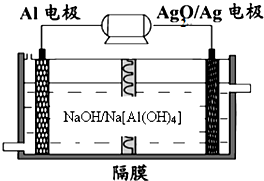 (2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(min) 浓度(mol/L) |
0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com