(2010?和平区一模)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
问题1 工业生产碘酸钾的流程如下:
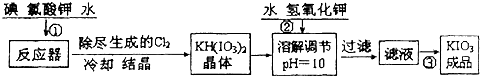
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同.请写出反应器中发生反应的化学方程式:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是
蒸发结晶
蒸发结晶
.
| 温度/℃ |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
问题2 已知:KIO
3+5KI+3H
2SO
4=3K
2SO
4+3I
2+3H
2O; I
2+2S
2=2I
-+S
4 .
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO
3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10
-3mol/L的Na
2S
2O
3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是
mg/kg(以含w的代数式表示).
(2)学生乙又进行了下列实验:
| 操作步骤 |
实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. |
溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. |
溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示
4I-+4H++O2=2I2+2H2O
4I-+4H++O2=2I2+2H2O
.
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:
偏大
偏大
(填“偏大”、“偏小”或“正确”).
其原因是
过量的I-会被空气中的O2氧化为I2
过量的I-会被空气中的O2氧化为I2
.




 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案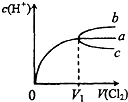 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )