
����Ŀ������������Ű�����ཡ������������Ӱ�죮ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO![]() 2CO2��g��+N2��g����H��O
2CO2��g��+N2��g����H��O
����Ӧ������ʱ��������ͼ1��ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�����������ʱ��ͼ����ͼ2��ʾ������˵����ȷ���� �����Ӧ��ĸ����

A��a1��a2
B��b1��b2
C��t1��t2
D��ͼ2����Ӱ�����������
E��ͼ1����Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ�

��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4��g��+2NO2��g��![]() N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
2NO2��g��![]() N2O4��g����H=��56.9kJ/mol H2O��g��=H2O��l����H=��44.0kJ/mol
N2O4��g����H=��56.9kJ/mol H2O��g��=H2O��l����H=��44.0kJ/mol
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ�� ��
��3��CH4��H2O��g�� �ڴ������淢����ӦCH4+H2OCO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�������
�¶�/�� | 800 | 1000 | 1200 | 1400 |
ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
���÷�Ӧ�� ��Ӧ������ȡ����ȡ�����
��T��ʱ����1L�ܱ�������Ͷ��l mol CH4��l mol H2O��g����ƽ��ʱc��CH4��=0.5mol/L�����¶��·�ӦCH4+H2O![]() CO+3H2��ƽ�ⳣ��K= ��
CO+3H2��ƽ�ⳣ��K= ��
��4������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��100ml1mol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��
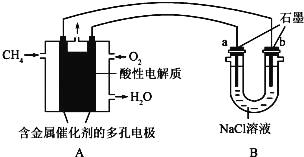
������ȼ�ϵ�صĸ�����Ӧʽ��
��������Һ��pH= ����������������������Һ��Ӧ��
�������������������ڱ�״������ L��
���𰸡���1����BC����BD��
��2��CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=��898.1kJ/mol��
��3����������K=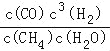 =
=![]() =6.75��
=6.75��
��4��CH4��8e��+2H2O=CO2+8H+����14����1.68��
��������
�����������1����ʹ�ô�����ֻ�ӿ췴Ӧ���ʣ��ﵽƽ������ʱ���٣����a1<a2��b2>b1��t1>t2�������Ի�ѧƽ����Ӱ�죬������Ӱ�����ȣ���ѡ��BC��ȷ����A������Ӧ�Ƿ��ȷ�Ӧ�������Ǿ������������ŷ�Ӧ���У��¶����ߣ���Ӧ���������ﵽƽ�ⷴӦ���ʲ��ٸı䣬������ͼ��t1ʱ�̺�Ӧ���ʻ��ڸı䣬˵��t1ʱ��û�дﵽƽ�⣬�ʴ���B��t1ʱ�̣����ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��C��t1ʱ�̣��ﵽƽ�⣬���ʵ������ٸı䣬������ͼ��t1ʱ�̺����ʵ������ڷ����仯��˵��û�дﵽƽ�⣬�ʴ���D�����ݻ�ѧƽ��״̬�Ķ��壬�ﵽƽ�⣬����������ٸı䣬����ͼ��t1ʱ�̴ﵽƽ�⣬����ȷ��(2)��CH4��g��+2NO2��g��![]() N2��g��+CO2��g��+2H2O��g������2NO2��g��
N2��g��+CO2��g��+2H2O��g������2NO2��g��![]() N2O4��g������H2O��g��=H2O��l����CH4��N2O4=N2��2H2O��CO2���������������3�������ó��� CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=��898.1kJ/mol��(3)����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ������˵��������Ӧ������У�������Ӧ�����ȷ�Ӧ��
N2O4��g������H2O��g��=H2O��l����CH4��N2O4=N2��2H2O��CO2���������������3�������ó��� CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=��898.1kJ/mol��(3)����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ������˵��������Ӧ������У�������Ӧ�����ȷ�Ӧ��
�� CH4+H2O![]() CO+3H2
CO+3H2
��ʼ��1 1 0 0
�仯��x x x 3x
ƽ�⣺1��x 1��x x 3x��
���ݼ����Ũ�����x=0.5��K=c3(H2)��c(CO)/[c(H2O)��C(CH4)]= ![]() =6.75����4�������������ԣ���˸�����ӦʽΪCH4��2H2O��8e��=CO2��8H������ ��ⱥ��ʳ��ˮ��2NaCl��2H2O
=6.75����4�������������ԣ���˸�����ӦʽΪCH4��2H2O��8e��=CO2��8H������ ��ⱥ��ʳ��ˮ��2NaCl��2H2O![]() 2NaOH��H2����Cl2����100��10��3��1molNaClȫ����⣬�������������ʵ���Ϊ0.05mol�������NaCl���һ����ˮ��2H2O
2NaOH��H2����Cl2����100��10��3��1molNaClȫ����⣬�������������ʵ���Ϊ0.05mol�������NaCl���һ����ˮ��2H2O![]() 2H2����O2��������n(OH��)=0.05��2mol=0.1mol ��c(OH��)=0.1��100��10��3mol��L��1=1����c(H��)=10��14mol��L��1����pH=14�����������ķ����������ϲ�����������Ϊ(0.05��0.05/2)��22.4L=1.68L��
2H2����O2��������n(OH��)=0.05��2mol=0.1mol ��c(OH��)=0.1��100��10��3mol��L��1=1����c(H��)=10��14mol��L��1����pH=14�����������ķ����������ϲ�����������Ϊ(0.05��0.05/2)��22.4L=1.68L��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��14C�����ڿ��ţ���14����ָ�� ��
A.������
B.���������
C.������
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����Ҫ��ˮ��Դ�����з��������ڵ�����ˮ����
A. ���� B. ���˷� C. ��Һ�� D. ��ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ô���(��Ca2+��Mg2+��SO42��������)Ϊ��Ҫԭ�ϲ��á������Ƽ����������ͻ���NH4Cl��������������ͼ��ʾ�������й�˵����ȷ����
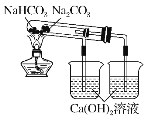
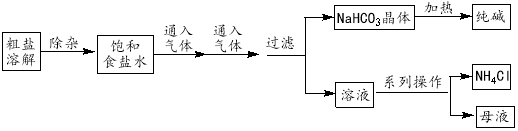
A���Դ�����Һ���ӿ����μ���NaOH��Na2CO3��BaCl2���ټ������������ҺpH
B������ʳ��ˮ����ͨ�������ΪCO2
C������ͼ�еġ�ϵ�в���������ʵ�����н��У�һ����Ҫ������
D����ͼ��ʾװ�ÿ��ԱȽ�Na2CO3��NaHCO3���������ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м������ʶ�����ѧ��ѧ�������ᣬ����ͬ�����£�������ǿ����
A. H2CO3 B. H2SiO3 C. H3PO4 D. H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʫ�������ϵ���˿����������ɻ���ʼ������˿����ֱ�ָ�� ��
A����ά�� ��֬ B�������� ���� C������ ��֬ D�������� ��֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼������������ѧ��ѧ��Ҫ�ķǽ���Ԫ�أ��ڹ�ũҵ�������й㷺��Ӧ�ã�
��1�����ڷ��䡰�칬һ�š��ij������Ż����ȼ����Һ̬ƫ��������CH3��2N-NH2����������Һ̬�����������������ڷ�Ӧ�����зų�����������ͬʱ������������Ⱦ�����壮��֪�����£�0.1molȼ����ȫȼ���ͷų�������Ϊ255kJ����д���÷�Ӧ���Ȼ�ѧ����ʽ__ ��
��2��298Kʱ����2L���ܱ������У��������淴Ӧ2NO2��g��![]() N2O4��g����H=-a kJmol-1 ��a��0����N2O4�����ʵ���Ũ����ʱ��仯��ͼ1����ƽ��ʱ��N2O4��Ũ��ΪNO2��2�����ش��������⣮
N2O4��g����H=-a kJmol-1 ��a��0����N2O4�����ʵ���Ũ����ʱ��仯��ͼ1����ƽ��ʱ��N2O4��Ũ��ΪNO2��2�����ش��������⣮

�� 298kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ___________��������Ӧ��398K���У�ijʱ�̲��n��NO2��=0.6mol��n��N2O4��=1.2mol�����ʱV������_ _V�����������������������=������

�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ3��ʾ������˵����ȷ����___________
a��A��C����ķ�Ӧ���ʣ�A��C
b��B��C����������ƽ����Է���������B=C
c��A��C�����������ɫ��A�Cdz
d����״̬B��״̬A�������ü��ȵķ���
��3��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺������100mL 0.1molL-1NH4HSO4��Һ�еμ�0.1molL-1NaOH��Һ���õ�����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ��a��b��c��d��e����㣬��ˮ�ĵ���̶�������___________��������Һ��c��OH-������ֵ��ӽ�NH3H2O�ĵ��볣��K��ֵ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л����У�ֻ�������ˮ����һһ�������
A���ױ���������ϩ C����Ȳ����ϩ�����Ȼ�̼
B�����顢�����Ҵ� D����ϩ������ ���Ȼ�̼
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com