
【题目】元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.
(1)Y与Z可形成多种化合物. ①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]. ①基态X2+的电子排布式是 .
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 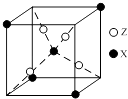
【答案】
(1)O;三角锥形;SeO2
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能
(3)1s22s22p63s23p63d6;14mol
(4)Fe3S8
【解析】解:元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2 , 则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4 , 则Z为S元素.(1)①同主族自上而下电负性减小,故电负性O>S,所以答案是:O;②离子SO32﹣中S原子孤电子对数= ![]() =1,价层电子对数=3+1=4,为三角锥形,所以答案是:三角锥形;③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2等,所以答案是:SeO2;(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,所以答案是:H2O分子与乙醇分子间可形成氢键,而H2S不能;(3)①基态Fe2+的电子排布式是:1s22s22p63s23p63d6 , 所以答案是:1s22s22p63s23p63d6;②氨气分子中有3个σ键,CN﹣中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,所以答案是:14mol;(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4×
=1,价层电子对数=3+1=4,为三角锥形,所以答案是:三角锥形;③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2等,所以答案是:SeO2;(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,所以答案是:H2O分子与乙醇分子间可形成氢键,而H2S不能;(3)①基态Fe2+的电子排布式是:1s22s22p63s23p63d6 , 所以答案是:1s22s22p63s23p63d6;②氨气分子中有3个σ键,CN﹣中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,所以答案是:14mol;(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4× ![]() =1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8 , 所以答案是:Fe3S8 .
=1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8 , 所以答案是:Fe3S8 .


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】将190g MgCl2溶于水配制成1L溶液.
(1)该溶液中MgCl2的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的MgCl2溶液500mL,需该溶液的体积为 .
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别碳酸钠和碳酸氢钠固体的方法中错误的是( )
A.分别取两种固体样品,加热产生气体的是碳酸氢钠
B.分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠
C.分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠
D.分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中容易产生有害的含铬工业废水和含氰废水,严重威胁人类的健康和安全.图1是处理工业含铬废水和含氰废水的工艺流程. 
已知:含铬废水中铬的存在形式为Cr2O72﹣ , Cr元素常见的化合价+3、+6,含氰废水中有CN﹣存在.
请回答下列问题:
(1)含氰废水中有CN﹣存在,其中C元素的化合价为 .
的代数式表示)
(2)向含铬废水中加下列哪种物质将pH调整到2~3,(填字母).
a.稀盐酸 b.稀硫酸 c.稀硝酸
的代数式表示)
(3)pH>10时,图中反应Ⅱ中的NaClO可以将CN﹣氧化为两种无毒物质,请写出反应的离子方程式 .
的代数式表示)
(4)经过图中反应Ⅰ和图中反应Ⅱ后,将两种废水混合的目的是
的代数式表示)
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72﹣的废水,原理示意图如图2: 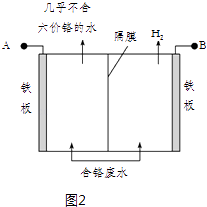
阳极区域溶液中发生反应的离子方程式为 . 若不考虑气体的溶解,当收集到H2 13.44L(标准状况)时,被还原的Cr2O72﹣物质的量为 . 为了使Cr3+和Fe3+转化为Fe (OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则溶液中c (Cr3+)=molL﹣1 . (已知:Ksp[Fe (OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
的代数式表示)
(6)在25℃下,将a molL﹣1 NaCN溶液与0.01molL﹣1盐酸等体积混合(忽略溶液体积变化),反应后测得溶液pH=7,HCN的电离常数Ka为 . (用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列说法正确的是 ( )
A. 光导纤维的主要成分是硅 B. 晶体硅能用来制造太阳能电池
C. 水晶项链的主要成分是硅酸盐 D. 二氧化硅是一种半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.可用铝制容器盛装稀硫酸
B.Na2O2可用于呼吸面具中作为氧气的来源
C.Fe2O3常用于制造红色油漆和涂料
D.Si可用于制造太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( ) 
A.通入的CO2气体为11.2 L
B.A溶液中n(NaHCO3)=2n(Na2CO3)
C.A溶液中既含NaOH,又含Na2CO3
D.A溶液中一定只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦氢能
A. ①②③④B. ②③⑥⑦C. ①②⑤⑥⑦D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题: 
(1)烧瓶中发生反应的化学方程式是;
(2)B瓶中的溶液是;C瓶中的溶液是 .
(3)玻璃管D中发生反应的化学方程式为 .
(4)干燥管E中盛有碱石灰,其作用是(回答一点即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com